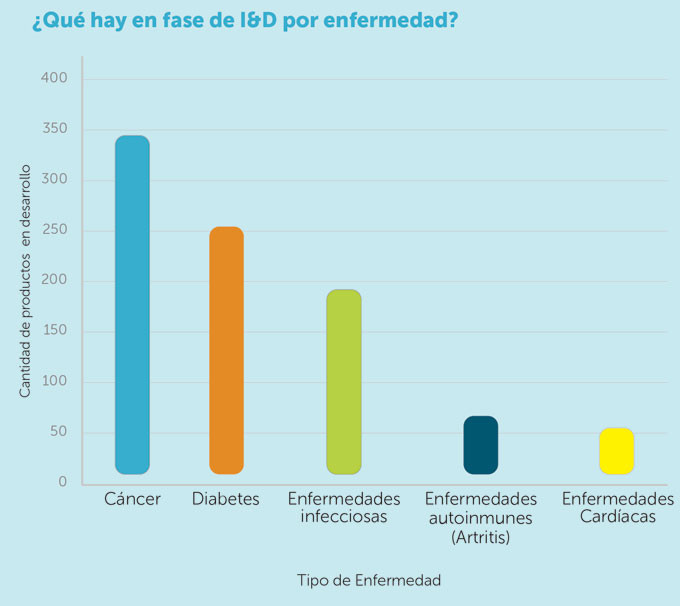
Casi 350 productos biológicos están en desarrollo frente al cáncer, mientras que más de 250 se están desarrollando para tratar la diabetes. Tras ellos, enfermedades infecciosas, autoinmunes y cardíacas lideran el número de proyectos de I+D que hay actualmente con medicamentos biológicos. Así se recoge en una infografía realizada por Farmaindustria y la Federación Internacional de la Industria Farmacéutica (IFPMA). Un desarrollo de nuevos productos que permiten salvar millones de vidas, al tiempo que reducen los costes sanitarios y permiten finalmente una sociedad más saludable, según exponen las patronales de la industria farmacéutica.
En la misma gráfica se indica el proceso de producción de los medicamentos biológicos, modificando genéticamente organismos vivos para que finalmente puedan producir el fármaco buscado y se exponen gráficamente los países que cuentan con una legislación específica sobre biosimilares, algo que ofrece garantías a los pacientes sobre la calidad de los productos que vienen a competir con los medicamentos bioterapéuticos. Una legislación que ya está presente en la mayoría de países avanzados.
Este asunto es muy importante ya que se asegura que los nuevos medicamentos competidores cumplen con unos requisitos de calidad y seguridad asemejables a los originales. De este modo, los biosimilares son productos altamente similares al bioterapéutico de referencia que ha sido autorizado con un expediente de registro completo ante las autoridades regulatorias. Además, estos productos biosimilares deben presentar documentación con pruebas clínicas y analíticas comparativas completas de acuerdo con las regulaciones. Todo ello permite asegurar que las variaciones que se pudieran producir son menores con respecto al producto bioterapéutico innovador de referencia.
Por el contrario, si no hay legislación pueden aparecer productos bioterapéuticos no comparables que pretenden ser copia de otro medicamento bioterapéutico, aunque no fue autorizado de acuerdo a las directrices de la Organización Mundial de la Salud (OMS). De este modo este producto no comparable o se desarrolla con comparaciones frente a frente limitadas que prueban la biosimilaridad con el producto de referencia o es un producto con estándares de aprobación poco claros y, por ello, plantea un riesgo potencial tanto para los paciente como para la salud pública.

























 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: