 CRITERIOS DE FINANCIACIÓN Y REEMBOLSO DE LOS MEDICAMENTOS HUÉRFANOS
CRITERIOS DE FINANCIACIÓN Y REEMBOLSO DE LOS MEDICAMENTOS HUÉRFANOS
Agencia de Evaluación de Tecnología Sanitaria.
Para acceder al documento en pdf y para consultar las tablas y figuras, acceda aquí.
RESUMEN
INTRODUCCIÓN Y OBJETIVO
Dado su elevado precio, los medicamentos huérfanos no suelen ser coste- efectivos bajo los umbrales estándares de aceptación de la evaluación económica. Sin embargo, la sociedad puede considerar relevante tener en cuenta otros criterios adicionales en su decisión de financiación y reembolso público. Este trabajo pretende identificar los criterios que podrían ser relevantes, y aquéllos que efectivamente imperan en la práctica real de los países desarrollados.
METODOLOGÍA
Se realizó una revisión de literatura, a partir de bases bibliográficas relevantes y fuentes de literatura gris, para identificar tanto artículos teóricos o empíricos sobre criterios de financiación/reembolso de los medicamentos huérfanos, como sobre políticas aplicadas en los principales países de la UE, Estados Unidos, Australia y Canadá.
RESULTADOS
La mayor parte de los artículos encontrados considera que los criterios de coste- efectividad no deben ser los únicos utilizados para justificar la financiación de un medicamento huérfano, si bien existe un debate sobre los criterios adicionales concretos a considerar. La decisión podría basarse en argumentos de índole humanística (justicia, equidad, regla de rescate), clínica (gravedad de la enfermedad, disponibilidad de alternativas terapéuticas, cambio del curso de la enfermedad) y económica (coste de oportunidad, impacto presupuestario, sostenibilidad del sistema). Se resumen los principales argumentos expuestos a favor y en contra de cada argumento. Por otra parte, se comprueba que la mayor parte de los países desarrollados basan la financiación de los medicamentos huérfanos en ciertos criterios adicionales, con el fin de acelerar el acceso a los mismos por parte de los pacientes con enfermedades raras, sobre todo si ésta es grave, carece de alternativas terapéuticas y afecta a un número reducido de personas.
DISCUSIÓN Y CONCLUSIONES
Tanto el debate teórico como la práctica real sugiere que el criterio de eficiencia no es ni debe ser el único para decidir la financiación pública de los medicamentos huérfanos. Se están introduciendo nuevos instrumentos de financiación y debatiendo distintos esquemas de decisión multicriterio para ayudar a conciliar las preferencias sociales con la sostenibilidad del sistema sanitario.
-
INTRODUCCIÓN Y OBJETIVO
Las enfermedades raras (EERR) son aquellas dolencias graves, potencialmente mortales o crónicamente debilitantes que están asociadas a una baja prevalencia, si bien su definición concreta difiere entre países, en función del límite de prevalencia fijado.
En la UE, se considera que una enfermedad es rara cuando afecta a menos de 5 de cada 10.000 personas1. Por su parte, en EEUU una enfermedad es rara cuando afecta a menos de 200.000 personas (lo que equivale a una tasa de prevalencia de 66/100.000 hab.), en Japón cuando afecta a menos de 50.000 personas (39/100.000 hab.) y en Australia cuando afecta a menos de 2.000 personas (9/100.000 hab.)2.
Se estima que existen más de 6.000 enfermedades raras distintas, y que la prevalencia del conjunto de este tipo de enfermedades oscila entre el 6% y 8% de la población de la UE, es decir, afectan a entre 44 y 59 millones de europeos3. Bajo estos criterios, se estima que en España existen unos 3 millones de afectados.
A pesar de su diversidad, la mayor parte de las enfermedades raras comparten un conjunto de características comunes, entre las que destacan4:
— Son graves, crónicas, a menudo degenerativas y potencialmente mortales.
— En más del 50% de ellas el comienzo de la enfermedad tiene lugar en la niñez.
— La calidad de vida y autonomía personal de los pacientes se ven comprometidas.
— Muchas no tienen tratamiento específico efectivo y la práctica médica consiste únicamente en paliar los síntomas.
— Existe desconocimiento sobre el origen y manejo de la enfermedad.
— Su diagnóstico suele ser un proceso lento y difícil5.
— Hay desinformación sobre especialistas o centros médicos a los que acudir.
— Requieren un manejo y un seguimiento multidisciplinar.
— Implican una gran carga psicosocial a los pacientes y sus familias.
— Suponen aislamiento y falta de contacto con otras personas afectadas.
— Acarrean notables pérdidas de oportunidades sociales y económicas.
A la hora de desarrollar un medicamento huérfano (MH) dirigido a tratar una ER, las empresas farmacéuticas se enfrentan a dificultades inherentes a este tipo de fármacos. La heterogeneidad de la enfermedad y el limitado conocimiento sobre la misma se une a la necesidad de realizar ensayos clínicos a partir de muestras pequeñas, dispersas y fragmentadas de pacientes. Todo ello eleva tanto la inversión necesaria para desarrollar un nuevo tratamiento como la incertidumbre asociada a su efectividad clínica.
Dada la baja prevalencia de las enfermedades raras y la existencia de fallos de mercado, el precio de los medicamentos huérfanos suele ser elevado, ya que los costes de la innovación deben ser recuperados con ventas a un número reducido de pacientes6,7. Dado su elevado precio, bajo los umbrales estándares de eficiencia, el medicamento huérfano será muy probablemente clasificado como no coste-efectivo, dificultando el acceso de los pacientes. Sin embargo, la sociedad podría estar dispuesta a ser más laxa en este sentido, considerando algunos criterios alternativos para decidir la introducción de este tipo de tratamientos en el sistema sanitario público.
Las actuales políticas sobre enfermedades raras se encuentran en una disyuntiva que no acaba de satisfacer a ninguna de las partes implicadas. Por un lado, dado su elevado precio, la mayor parte de los MMHH no cumplen los criterios estándar de coste-efectividad, y no deberían por tanto ser financiados públicamente. Sin embargo, los decisores públicos también se enfrentan a dilemas éticos y a problemas políticos si dificultan el acceso a medicamentos esenciales a pacientes en peligro8. Por otro lado, las empresas se quejan de que, a pesar de recibir incentivos públicos para desarrollar un medicamento huérfano, el reembolso del producto resultante de la investigación no siempre es aprobado. Finalmente, los pacientes claman que, a pesar de que existe un tratamiento para su enfermedad rara, el acceso al mismo puede estar restringido.
Cómo decidir la financiación pública de los MMHH es un tema que divide a la comunidad científica. Existe un debate sobre los criterios que deberían ser considerados para financiar públicamente un medicamento huérfano. Algunos autores defienden que sería válido tratarlos de manera diferente a los medicamentos para enfermedades prevalentes, dadas sus particularidades. Por el contrario, otros autores sostienen que no hay razón para tratar a estos medicamentos de manera diferencial.
El primer objetivo de este trabajo en precisamente resumir el debate producido a nivel teórico sobre los criterios que deberían, o no, tenerse en cuenta a la hora de decidir la financiación y reembolso público de los MMHH, resaltando los argumentos expuestos a favor y en contra.
Por su parte, la mayor parte de los países desarrollados ha aprobado legislación específica para incentivar el desarrollo de nuevos medicamentos huérfanos y fomentar el acceso de los pacientes a los mismos, aduciendo motivos de salud pública, fallos de mercado y externalidades positivas. Desde entonces, el número de MMHH comercializados se ha incrementado de una manera notable9,10.
Por ello, el segundo objetivo de este trabajo es revisar los distintos criterios que son efectivamente tenidos en cuenta en los principales países desarrollados a la hora de decidir la financiación y reembolso público de los medicamentos huérfanos.
Este trabajo pretende así aportar una visión del panorama teórico y práctico actual en el ámbito de la financiación pública de los medicamentos huérfanos, un sector en auge y con un futuro prometedor, pero cuya expansión no debe comprometer la sostenibilidad financiera del sistema sanitario a medio y largo plazo.
- METODOLOGÍA
Para la elaboración de este documento se llevó a cabo una revisión narrativa de literatura sobre los criterios a considerar al enfrentarse a la financiación pública y/o evaluación económica de un nuevo medicamento huérfano, tanto desde una perspectiva teórica (¿qué criterios deberían, o no, tenerse en cuenta?) como práctica (¿qué criterios se consideran en la práctica en los principales países desarrollados?).
En la perspectiva teórica se incluyeron tanto elementos argumentales en un ámbito puramente teórico como ejercicios realizados empíricamente a ciertos grupos poblacionales para aproximar sus preferencias sociales respecto a la financiación pública de MMHH, lo que permite comprobar si la robustez de un criterio teórico se mantiene o no en un plano aplicado.
La segunda perspectiva —la práctica real— incluye artículos que describan o analicen los criterios de financiación y/o reembolso público de MMHH actualmente vigentes en los principales países desarrollados (países de la Unión Europea, Estados Unidos, Australia y Canadá), así como los esquemas actuales de financiación de dichos medicamentos.
La estrategia de búsqueda consistió en seleccionar y combinar una lista de términos y conceptos en el conjunto de bases de datos seleccionadas.
— La estrategia de búsqueda incluyó los siguientes términos, utilizando tanto lenguaje libre como controlado: rare disease; orphan drug; insurance; cost- effectiveness; cost-utility; QALYs; economic evaluation; Health Technology Assessment; reimbursement; financing; rescue.
— El principal motor de búsqueda utilizado fue Medline, así como fuentes de literatura gris. Se revisaron además guías metodológicas de evaluación económica de agencias evaluadoras en países europeos, Canadá, Australia y EEUU, y recomendaciones de instituciones reguladoras y organizaciones no gubernamentales (OCDE, Comisión Europea, EMA, EURORDIS, OMS).
En la revisión se incluyeron artículos en inglés o en español que definieran o debatieran, de manera teórica o empírica, criterios de evaluación económica y/o financiación de MMHH ya comercializados (Tabla 1). Quedan así excluidos artículos sobre incentivos a la investigación y desarrollo de nuevos fármacos o a la realización de ensayos clínicos.
Se contemplan los trabajos dirigidos al conjunto de MMHH, excluyendo por tanto aquellos artículos enfocados en una patología o fármaco concretos. Quedan también excluidos las guías de práctica clínica, los estudios de carga de la enfermedad, los análisis de impacto presupuestario, el material periodístico y las revisiones de literatura.
Tabla 1. Criterios de inclusión y exclusión de artículos aplicados en la revisión de literatura
El artículo es sobre: Y trata uno o más de los siguientes temas:
Enfermedades raras o medicamentos huérfanos. – Financiación o reembolso público.
– Evaluación económica.
– Coste-efectividad.
– Ética y/o justicia social.
Condicionado a: Condicionado a:
– Escrito en inglés o castellano.
– Diseño descriptivo, analítico, narrativo o debate teórico (excluido material periodístico y revisiones de literatura).
– Publicado en revistas indexadas o en páginas oficiales.
– Texto completo disponible.
– Publicados entre 2004 y 2015.
– Referente a países de la UE, EEUU, Canadá o
Australia.
– Define o debate criterios de evaluación económica y/o financiación de MMHH ya comercializados (excluidos artículos sobre incentivos a ensayos clínicos o a la I+D).
– Trabajos dirigidos al conjunto de MMHH (excluidos artículos sobre una patología o fármaco concreto).
– Excluidos guías de práctica clínica, análisis
de impacto presupuestario, estudios de carga de la enfermedad.
Tras revisar los títulos y abstracts resultantes de la búsqueda, se eliminaron los artículos que no cumplían los criterios de inclusión. Finalmente, la revisión incluyó un total de 48 trabajos, de los cuales 32 se refieren al contexto teórico y los 16 restantes a la práctica real en los países desarrollados.
- CRITERIOS DE FINANCIACIÓN DE LOS MEDICAMENTOS HUÉRFANOS DESDE UNA PERSPECTIVA TEÓRICA
Aunque existen algunas excepciones11-14 la mayor parte de los estudios revisados abogan por complementar la evaluación económica de todo nuevo medicamento huérfano con criterios adicionales a los de coste-efectividad, si bien el tipo de argumentos a incluir difiere entre estudios.
La Tabla 2 aglutina el debate mantenido en la literatura sobre los criterios adicionales que deberían, o no, considerarse en la financiación y reembolso público de medicamentos huérfanos más allá del criterio de coste-efectividad. De los 32 artículos revisados, 5 plantean ejercicios empíricos de revelación de preferencias (se marcan con un *), mientras que los 27 restantes se manejan en un plano puramente teórico.
Los argumentos planteados se agrupan en tres bloques diferenciados según se trate de criterios de índole humanística, clínica o económica. Además de señalar si cada uno de los trabajos se refirió a dichos criterios, en la tabla se especifica si los autores se posicionaron explícitamente a favor o en contra de utilizarlo para apoyar la decisión de financiación del medicamento huérfano, o si bien los autores únicamente describen los argumentos a favor y en contra del mismo, pero no se decantan por ninguno («mención»). De esta manera es posible visualizar los elementos que resultan más y menos controvertidos en la literatura.
ARGUMENTOS HUMANÍSTICOS
El principal origen de las discrepancias sobre los argumentos humanísticos parte del concepto que se tenga sobre la justicia y la equidad en la toma de decisiones sanitarias.
Por un lado, la visión igualitarista pone de manifiesto la máxima de que los pacientes con EERR deberían disponer de la misma oportunidad de recibir tratamiento que otros pacientes con enfermedades más comunes, y que la sociedad tiene la obligación de proveer un acceso igualitario a un nivel mínimo de asistencia sanitaria15,16. Sus defensores argumentan que la propia legislación europea establece que las personas que sufren EERR tienen derecho a recibir la misma calidad de tratamiento que otros pacientes1,17,18. Aducen que por tanto sería injusto no tratar a estas personas simplemente porque su enfermedad sea rara19, y que las cuestiones éticas de no abandono y solidaridad deben primar sobre el utilitarismo16,17,20-23.
Por su parte, el punto de partida de los utilitaristas es maximizar el bienestar global de la sociedad, dados los limitados recursos disponibles. Para ello, abogan por valorar de igual modo la ganancia en salud de cada paciente. Por lo tanto, al invertir en MMHH no coste-efectivos se estaría dando más valor a la mejora en salud en EERR que en enfermedades comunes, lo cual desde el utilitarismo no sería ni ético ni eficiente11.
Tabla 2. Criterios alternativos al coste-efectividad para considerar la financiación y reembolso público de MMHH/ultra-huérfanos
En el debate sobre equidad, la distinción entre equidad horizontal (igual tratamiento de los iguales) y vertical (desigual tratamiento de los desiguales) ocupa un lugar destacado, al igual que las diferencias entre igualdad en el uso de recursos e igualdad en los resultados en salud8,13. Seis de los trabajos analizados se mostraron contrarios a utilizar el criterio de justicia/equidad en la decisión de financiación de los MMHH11,12,14,25,27,36.
Por otro lado, más de la mitad de los trabajos revisados se refieren a la «regla de rescate», un concepto acuñado en 1986 por Jonsen para referirse al imperativo moral de salvar una vida que está en peligro inminente, como cierta forma de solidaridad41. La mayor parte de los trabajos rechaza la utilización de este argumento como criterio explícito de evaluación, en tanto que se trata de un imperativo psicológico más instintivo que racional que se toma sin tener en cuenta su coste de oportunidad11,12,14,25,27,35. Otros, en cambio, lo defienden en determinadas circunstancias excepcionales como una respuesta comprensible de compasión y deber moral23,39,42.
La regla de rescate tiende a confundirse con el fenómeno de la víctima identificable, que se vale de los medios de comunicación para ejercer presión sobre los decisores35. Algunos autores la interpretan como un compromiso de no abandono de los pacientes cuando la enfermedad es grave, no hay tratamientos alternativos disponibles y el número de casos afectados es bajo23. Sus detractores argumentan que este criterio discrimina a los individuos no identificables, y que el riesgo de daño inminente no afecta únicamente a las enfermedades raras12.
Finalmente, otro potencial criterio humanístico para el tratamiento diferenciado de los MMHH es precisamente el inherente carácter de rareza, o baja prevalencia, de la enfermedad a la que se dirige. Este argumento, que subyace en la legislación de incentivos a la inversión en I+D y generación de evidencia científica, es sin embargo rechazado para la decisión de reembolso como elemento de valor per se, aislado de otros conceptos relevantes como la severidad de la enfermedad o la inexistencia de alternativas terapéuticas11-14,19,20,26,31,35.
Hemos identificado cinco ejercicios empíricos realizados en Canadá, el Reino Unido y Noruega que tratan de explorar las preferencias sociales reales de algunos grupos de población sobre los criterios que deben guiar las decisiones de financiación de los MMHH.
Una primera aproximación fue el Consejo Ciudadano convocado por el NICE británico en 2004 para conocer su opinión respecto a la financiación de los medicamentos ultra-huérfanos (< 1/50.000 hab.). Veinte de los 27 miembros apoyaron la modificación de la evaluación estándar de un ultra-huérfano, para permitir su financiación. Concluyeron que la rareza en sí misma no es un factor determinante, sino la conjunción de otros elementos como el grado de severidad de la enfermedad, la efectividad del tratamiento y el hecho de que la enfermedad ponga en riesgo la vida40.
Un experimento de elección discreta realizado en Canadá a partir de una muestra de estudiantes universitarios arrojó resultados más cautelosos, pero en la misma línea. En este caso no se percibió una mayor disposición a pagar por los MMHH frente a los prevalentes, siendo los atributos decisivos para la cobertura igualmente relevantes entre ambos grupos (también la severidad de la enfermedad y la efectividad del fármaco)32.
Por su parte, Desser llevó a cabo primero un estudio piloto y posteriormente dos experimentos para explorar las preferencias de clínicos y de la población general sobre los MMHH en Noruega15,28,29. La rareza de la enfermedad tampoco se consideró un factor relevante en ninguno de estos ejercicios. Sin embargo, se halló una mayor exigencia de los clínicos, que se mostraron más reacios a priorizar MMHH costosos. En todo caso, también apoyaron que se destinara una pequeña partida de fondos presupuestarios a MMHH.
ARGUMENTOS CLÍNICOS
El segundo bloque de criterios alternativos se refiere a argumentos de índole clínica, que, como veremos en el siguiente apartado, son habitualmente aplicados por parte de los decisores de los distintos países.
Uno de los criterios más comúnmente mencionados es la gravedad o severidad de la enfermedad. Varios de los trabajos revisados abogan por que la evaluación económica sea más benévola si el medicamento en cuestión se dirige a una enfermedad rara severa que pone en riesgo la vida del paciente16,18,20,21,26. Aquí también entran en juego principios de justicia distributiva, en función de si se prefiere priorizar al más enfermo o a aquel sobre el que se vaya a obtener un mayor avance en salud. En todo caso, muchos autores aducen que la severidad no es una característica intrínseca de las EERR, sino que también puede afectar a las prevalentes, y que por tanto no debe utilizarse como estatus especial de acceso al mercado11-14,35, puesto que además supondría discriminar a las enfermedades crónicas.
La no disponibilidad de terapias alternativas también es un factor habitualmente considerado para un tratamiento diferenciado del MH. Sus defensores se basan en valores sociales, éticos y morales de solidaridad y no abandono de enfermos sin otra alternativa clínica6,16,18,20,21,23,30,39. Por su parte, sus detractores aducen que este argumento tampoco es exclusivo de los MMHH y que puede esconder una falacia discursiva, dado que el mejor tratamiento de soporte puede ser preferible a un MH de incierta eficacia que le suponga al paciente una peor calidad de vida11,12,14,25,35.
Un tercer posible criterio para tratar de manera más laxa a los MMHH es el grado de modificación del curso de la enfermedad o la magnitud de beneficio del tratamiento, ya que la sociedad valorará más un tratamiento que ofrezca un mayor impacto en la esperanza de vida y/o calidad de vida que otro que logre resultados más moderados por ser paliativo, sintomático o sustitutivo16,24,30.
Asimismo, se mencionan otros posibles criterios clínicos, como el perfil de seguridad del tratamiento o las externalidades positivas sobre patologías y tecnologías futuras21,40.
Los trabajos empíricos realizados revelan que la sociedad valora más las ganancias en salud de pacientes con peor pronóstico, y que el grado de severidad de la enfermedad y la efectividad el fármaco deben ser los principales criterios a considerar al decidir si pagar más por los MMHH, y solo entonces se pasaría a considerar otros criterios, como el coste de las terapias alternativas32,40.
ARGUMENTOS ECONÓMICOS
Como tercer bloque de criterios alternativos a considerar en la financiación de los MMHH cabe agrupar varios factores económicos, tales como la magnitud del
impacto presupuestario, el coste de oportunidad o la sostenibilidad del sistema sanitario, que muchos autores reclaman considerar junto con criterios humanísticos y clínicos.
El precio de los MMHH tiende a ser elevado, pero afecta a un número reducido de pacientes, por lo que algunos reclaman que la magnitud de su impacto presupuestario será reducida, lo cual debe tenerse en cuenta en la decisión de reembolso16,17,20,23,37. Otros autores cuestionan en cambio que el impacto presupuestario global de los MMHH sea tan reducido, en tanto que el número de aprobaciones y de pacientes tratados va en claro aumento13,14,31,34,35. En todo caso, éste constituye uno de los ítems en los que se asienta la toma de decisiones a nivel práctico, como veremos en el siguiente apartado.
El concepto de coste de oportunidad se refiere al hecho de considerar que reembolsar un MH no coste-efectivo sustrae recursos para otras tecnologías coste- eficientes que pueden afectar a más personas. De nuevo, la percepción de este concepto está muy relacionada con la de equidad, de modo que los utilitaristas consideran que el coste de oportunidad de tratar las EERR es elevado y creciente, lo que supone que financiarlos sería ineficiente, injusto e insostenible11-13,18,19,28,31,35, mientras que otros priorizan los aspectos éticos y de equidad social sobre los meramente económicos23,29.
Algunos autores opinan que la toma de decisiones debe ser un proceso transparente que debe incluir de manera explícita el coste de oportunidad de financiar el MH, ya que aplicar la regla de rescate a todos los MMHH que van a ir apareciendo en un futuro cercano pondría en riesgo la sostenibilidad a medio y largo plazo del sistema31,35,36.
Asimismo, varios trabajos coinciden en que se debe valorar no sólo el impacto económico del tratamiento, sino también el impacto social (incluyendo las pérdidas de productividad laboral, el coste de los cuidados personales, la carga sobre los cuidadores, etc.) que supondría la financiación del fármaco a corto y a largo plazo17,20,21,24,30.
También se ha mencionado la deseabilidad de considerar la (des)protección financiera del paciente, analizando el coste que le supondría la no financiación pública del MH24.
- CRITERIOS DE FINANCIACIÓN DE LOS MEDICAMENTOS HUÉRFANOS EN DISTINTOS PAÍSES DESARROLLADOS
Dado su elevado precio, la mayor parte de los MMHH no cumplen con los estándares tradicionales de coste-efectividad. Sin embargo, muchos acaban siendo reembolsados, lo que implica que en la práctica se tuvo en cuenta criterios adicionales8,43,44.
En la mayor parte de los países desarrollados, la financiación y reembolso público de los MMHH se realiza en base a los mismos criterios que para el resto de medicamentos, al menos formalmente45. Es decir, los MMHH deben demostrar su eficacia, seguridad y calidad, y también son sometidos a evaluación económica, si bien, como veremos a continuación, en la práctica a menudo se les aplican ciertas excepciones.
En la fase de pre-autorización, a menudo se les exige una evidencia clínica menos estricta que al resto de medicamentos, debido a los problemas inherentes de realizar ensayos clínicos con pocos sujetos6,46,47. De hecho, aunque los MMHH suponen solo el 10% del total de medicamentos autorizados por la Agencia Europea del Medicamento (EMEA) (1), éstos representan el 57% del total de autorizaciones condicionales y el 67% de las autorizaciones excepcionales, lo que da idea de la laxitud aplicada48.
Los países que no utilizan un análisis formal de coste-efectividad (España, Francia, Italia) han sido tradicionalmente más flexibles sobre la evidencia exigida a los MMHH, y ocasionalmente les han permitido fuentes de evidencia distinta de los ensayos clínicos. En Alemania, aunque la regulación no permite modificar las bases de la evidencia, bajo ciertas circunstancias se aceptan intervalos de confianza más amplios.
Por su parte, en general los países con procesos formales de evaluación económica (UK, Suecia, Holanda) no permiten a los MMHH rebajar los requerimientos sobre evidencia, ya que existen herramientas para manejar la incertidumbre, aunque en la práctica han hecho excepciones45. En UK, cuanto mayor sea el impacto presupuestario del MH, más robusta debe ser su evidencia clínica. Holanda permite ciertas excepciones cuando hay datos insuficientes sobre su efectividad, pero se solicita un análisis de impacto presupuestario de la implementación en el país. En Suecia, cuando la población a tratar es reducida, se acepta un mayor grado de incertidumbre en la evidencia clínica.
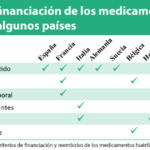
La Tabla 3 resume la evidencia encontrada acerca de los criterios exigidos en los principales países europeos, Australia, Canadá y EEUU para la evaluación y reembolso público de MMHH. También incorpora algunos de los esquemas de financiación de los MMHH más utilizados, que se tratarán en mayor detalle en el apartado de discusión.
(1) La EMEA es el órgano competente en la UE para autorizar los MMHH de manera centralizada, pero posteriormente son los propios países quienes deciden si financiarlos públicamente, estableciendo su precio y reembolso.
Tabla 3. Criterios de financiación/reembolso y esquemas de financiación de los MMHH
aplicados en la práctica en los países revisados
| País | Criterios para la financiación y reembolso de MMHH | Esquemas de financiación |
| España | Se aplican los mismos criterios que para el resto de medicamentos (Ley 29/2006, RDL 9/2011, RD 1/2015). No se requiere un análisis formal de CE. Se considera la gravedad de la enfermedad, las necesidades específicas de ciertos subgrupos, el valor terapéutico y social, la existencia de tratamientos alternativos, el grado de innovación y la racionalización del gasto sanitario.45,49-51 | Acuerdos de riesgo
compartido, principalmente en algunas CCAA, pero también a nivel nacional52. |
| Francia | Se someten al nuevo sistema de evaluación, que clasifica los nuevos medicamentos en 5 grupos en función de la severidad de la enfermedad, el tipo de tratamiento, su valor terapéutico añadido, su posición en la estrategia terapéutica, la existencia de alternativas y su impacto socioeconómico.53-55 | Riesgo compartido: precio
y volumen están vinculados desde el principio33. Autorizaciones para uso temporal49. |
| Italia | Se considera su ratio coste-efectividad incremental, aunque no se aplica un umbral formal de aceptación.
Se tiene en cuenta también la eficacia del medicamento, la existencia de tratamientos alternativos adecuados, el impacto presupuestario y el impacto sobre la inversión.33,45,49,54 |
Esquemas de acceso a pacientes.
Fondo destinado a MMHH. Acuerdos de riesgo compartido56 |
| Alemania | Se consideran criterios de eficacia y efectividad, pero están exentos de cumplir los criterios convencionales de CE. Si no existe un tratamiento alternativo, todo
medicamento recibe automáticamente el reembolso.33,45 |
Acuerdos entre empresas y fondos de enfermedad49. |
| Suecia | Se tiene en cuenta la relación coste-efectividad, el principio del valor humano y el de solidaridad y necesidad. Se aceptan mayores umbrales de CE en función de la gravedad de la enfermedad. Se tiene en cuenta el impacto presupuestario global, no el específico de cada MH. Cuando la población a tratar es reducida, se tiende a aceptar un mayor grado de incertidumbre en la evidencia clínica.44,45 | Reembolso completo o limitado a subgrupos de pacientes.
Esquemas de pago por resultados.33 |
| Bélgica | Se tiene en cuenta su valor terapéutico y social (en función de la gravedad de la enfermedad, la existencia de otros tratamientos y la carga económica para
el paciente si tiene que financiarse el tratamiento), su necesidad para la práctica clínica y su impacto presupuestario.43,54,55,57. En procesos complejos pueden surgir argumentos éticos (regla de rescate, derecho al tratamiento, igualdad en el acceso) y razones socioeconómicas43,57. |
Acuerdos precio-volumen. Límites de coste por paciente.56 |
| Holanda | Exentos de presentar una evaluación CE completa si el impacto presupuestario es reducido, si no existen tratamientos alternativos o si hay datos escasos. Se tiene en cuenta su eficacia clínica, su coste-efectividad y su impacto presupuestario.44,45,54 | Presupuesto específico para
MMHH56 |
País Criterios para la financiación y reembolso de MMHH Esquemas de financiación
UK Se someten a análisis coste-efectividad y en principio se les aplican los criterios estándares de evaluación. Consideraciones especiales caso a caso para tratamientos no coste-efectivos pero que alargan la esperanza de vida de poblaciones pequeñas con enfermedades terminales. Si el impacto presupuestario es reducido, se podría aceptar una mayor incertidumbre clínica y de coste-efectividad.
En Escocia se considera también la gravedad de la enfermedad, el impacto sobre la esperanza de vida o la calidad de vida, y si modifica el curso de la enfermedad.33,45,54,58
Australia Tienen en cuenta el ratio coste-efectividad. Si son clínicamente efectivos pero no coste-efectivos, se les aplica el Life-Saving Drug Programme que considera una versión de la regla de rescate cuando la enfermedad es muy grave y progresiva, no existen tratamientos alternativos efectivos y afecta a pocos pacientes.59-61
Canadá Formalmente no los priorizan de forma diferente al resto.
En algunos casos se ha tenido en cuenta la severidad de la enfermedad, la existencia de alternativas y la equidad en el acceso (por ejemplo, en medicamentos para tratar la enfermedad de Gaucher). En la provincia de Ontario se contempló la regla de rescate para el reembolso de algunos MMHH.33,60,62,63
EEUU Exentos de cumplir los criterios convencionales de CE.
El ejercicio de priorización de Oregón siguió el principio de la regla de rescate.33,64
Nota: CE: coste-efectividad.
Acuerdos de riesgo compartido6. Esquemas de acceso a pacientes56. Presupuesto específico para enfermedades prioritarias.
Esquemas de acceso a pacientes. Presupuesto específico para MMHH. Acuerdos de riesgo compartido.33
Esquemas de acceso a pacientes. Financiación sujeta a que el paciente participe en un registro prospectivo.33
Acuerdos de riesgo compartido.
Programas de acceso a pacientes que hayan alcanzado el máximo de cobertura
En general, a la hora de decidir su financiación pública, los MMHH son sometidos a los mismos procesos de decisión que el resto de medicamentos. En los países donde formalmente no se requiere una evaluación económica del fármaco para decidir su reembolso, tampoco a los MMHH se les exige un análisis formal de coste- efectividad (o utilidad). Algunos autores reclaman que el método real de evaluación es a menudo opaco, a pesar de los esfuerzos realizados para dotar al proceso de más transparencia49.
Por su parte, los países con sistemas formales de evaluación económica de los nuevos medicamentos, como por ejemplo Suecia, Holanda, el Reino Unido o Canadá, también someten a los medicamentos huérfanos al análisis coste-efectividad o coste- utilidad, si bien son más laxos con los umbrales de aceptación de coste por AVAC y en ocasiones les aplican criterios adicionales. Así, en Suecia se han llegado a aprobar medicamentos huérfanos con umbrales de aceptabilidad por encima de los 90.000 €/AVAC, por lo que claramente la decisión se fundamentaba en factores distintos al de coste-efectividad45.
Los criterios alternativos más utilizados en la práctica en los países revisados son la gravedad de la enfermedad, la disponibilidad de alternativas terapéuticas y la magnitud del impacto presupuestario, tal y como recoge la Tabla 4.
Tabla 4. Resumen de los criterios adicionales al coste-efectividad considerados en la práctica en los países seleccionados para la financiación/reembolso de los MMHH
| HUMANÍSTICOS | CLÍNICOS | ECONÓMICOS | OTROS | ||||||||
|
Justicia |
Equidad acceso | Regla rescate |
Rareza |
Severidad enf. |
Alternativas |
Modificación curso enf. |
Coste oport. |
Impacto presptrio | Sostenib. sistema | ||
|
ES |
3 |
3 |
3 |
Grado de innovación |
Racionalización gasto sanitario |
Utilidad social |
|||||
|
FR |
3 |
3 |
Valor añadido ter. | Impacto socioecon. | Tipo de tto;
pos. estratég. |
||||||
|
IT |
3 |
3 |
Impacto sobre la inversión | ||||||||
|
DE |
3 |
||||||||||
|
SW |
Valor humano y solidaridad |
3 |
Impacto global | ||||||||
|
BE |
3 |
3 |
(3) |
3 |
3 |
Valor añadido ter. |
3 |
Razones socioeconóm. | |||
|
NL |
3 |
3 |
3 |
||||||||
|
UK |
(3) |
3 |
3 |
3 |
3 |
||||||
|
AUS |
3 |
3 |
3 |
3 |
|||||||
|
CAN |
3 |
3 |
3 |
3 |
|||||||
|
USA |
3 |
||||||||||
Fuentes: 33,43-45,49,50,53-55,57-64
La severidad de la enfermedad se contempla explícitamente como criterio a considerar en la evaluación de financiación de un nuevo MH en países como España, Francia, Suecia, Bélgica, Reino Unido, Australia y Canadá43-45,49,53,54,59,60. Además, éste es uno de los dos criterios («afección que ponga en peligro la vida o conlleve una incapacidad crónica…») contemplados a nivel europeo para conceder a un medicamento la condición de «huérfano» en su autorización de comercialización, junto con el de necesidad médica no cubierta1.
La falta de alternativas terapéuticas, o necesidad médica no cubierta, constituye el criterio más habitualmente considerado para guiar el proceso de decisión alternativo al estándar. En Australia e Italia se refieren explícitamente a la inexistencia de alternativas efectivas o satisfactorias, distinguiéndolos de los tratamientos de soporte55,61. Alemania constituye un caso paradigmático en relación al uso de comparadores, ya que aplica a todos los medicamentos —sean o no huérfanos— el principio de financiación pública automática (sin necesidad de evaluar su coste- beneficio) cuando no existen alternativas terapéuticas. En cambio, si existe un tratamiento alternativo al nuevo MH, se lleva a cabo una evaluación económica en base a su valor y a sus costes45.
El tercer argumento clínico (la capacidad para modificar el curso de la enfermedad) es tenido en cuenta en esos términos sólo en UK, si bien la mayor parte de los países contemplan conceptos similares, como el grado de innovación (España) o el valor terapéutico añadido (Bélgica y Francia), un concepto que implícitamente recoge su capacidad para modificar la enfermedad, por ejemplo alargando la esperanza de vida o mejorando sustancialmente la calidad de vida45,50,53,58. Por ejemplo, en Escocia se tiene en cuenta el hecho de si el medicamento puede revertir, más que estabilizar, la enfermedad, avanzando hacia la terapia definitiva65. Por su parte, Francia ha establecido un sistema multi-criterio que clasifica las innovaciones farmacéuticas en 5 grupos en función de su beneficio terapéutico añadido y otros factores como su posición terapéutica estratégica o el tipo de tratamiento —preventivo, curativo o sintomático— del que se trate53.
Entre los argumentos económicos, la magnitud del impacto presupuestario es uno de los criterios de financiación/reembolso más utilizados, y se menciona como requisito explícito en países como Italia, Bélgica u Holanda y como requisito implícito (pequeña población a tratar) en Suecia, el Reino Unido, Australia y España45,49,50,54,60. Por ejemplo, UK puede hacer excepciones en el reembolso de tratamientos que superen los 30.000 £/AVAC siempre que cumplan ciertos criterios, como dirigirse a una población reducida de pacientes con una esperanza de vida corta y evidenciar que el fármaco puede mejorar sustancialmente la esperanza de vida del paciente49,58. Actualmente se está desarrollando un nuevo enfoque para la evaluación de MMHH.
En España, el real decreto legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos en la financiación del Sistema Nacional de Salud se posibilitará mediante la financiación selectiva y no indiscriminada, teniendo en cuenta, entre otros, el criterio de la racionalización del gasto público destinado a prestación farmacéutica y el impacto presupuestario en el SNS50.
En cierto modo, el coste de oportunidad del fármaco a evaluar se tiene en cuenta de manera implícita en la mayor parte de los países, en la medida en que su coste de adquisición se compara con el de las alternativas disponibles, si bien no siempre se contemplan otro tipo de costes que podrían ser relevantes en la decisión.
Otros criterios económicos tenidos en cuenta son el impacto socioeconómico del medicamento (Francia), el impacto sobre la inversión (Italia), razones socioeconómicas (Bélgica) y el impacto global de los MMHH en su conjunto (Suecia)43,45,49.
Respecto a los argumentos humanísticos, muchos de los países revisados los han tenido en cuenta, al menos implícitamente, al decidir el reembolso de un MH. Sólo Suecia reconoce de manera formal tanto el principio del valor humano, según el cual todos los seres humanos deben valer lo mismo, como el principio de solidaridad y necesidad, por el cual los recursos deben ser empleados allí donde la necesidad sea mayor, lo que en la práctica implica un mayor umbral de aceptabilidad para los MMHH49,54,66. En Bélgica también han surgido argumentos éticos43,57.
En relación a la equidad en el acceso, Bélgica contempla la carga económica que supondría al paciente la no financiación pública del MH. En Canadá muchos MMHH se acaban reembolsando en base a criterios de derecho al acceso a medicamentos potencialmente beneficiosos, si bien tienen en cuenta el estatus socioeconómico del paciente, al menos para algunas patologías como la enfermedad de Gaucher57,63,67. En España se tienen en cuenta las necesidades específicas de ciertos colectivos50.
Finalmente, la regla de rescate jugó un papel importante en el ejercicio de priorización de los recursos sanitarios realizado en el estado norteamericano de Oregón en 1990, que clasificó y financió las intervenciones sanitarias en función de su valor comunitario y de una base ética, alejándose de criterios puramente economicistas64. La iniciativa fue pionera, pero no estuvo exenta de críticas68,69. Esta regla, o una versión de la misma, se ha utilizado para MMHH en Australia, Canadá, Bélgica y UK.
En Australia, el Life Saving Drugs Program está específicamente diseñado para reembolsar MMHH no coste-efectivos que sin embargo pueden salvar vidas de personas que carecen de otras alternativas (farmacológicas o de otro tipo) si éstos constituyeran una carga financiera poco razonable para el paciente o sus cuidadores70. En la provincia canadiense de Ontario se utilizó el valor de salvar una vida independientemente de su coste como consideración adicional, si bien su aplicación fue más controvertida y complicada a medida que crecía el número de tratamientos disponibles, su precio y su impacto económico60,63. Bélgica cuenta con un fondo de uso compasivo que posibilita el acceso a pacientes cuya vida peligra y que carecen de alternativas satisfactorias55. Por su parte, en UK se considera en cierto modo la regla de rescate a través de los End of Life Treatments para los que se permiten mayores umbrales de aceptabilidad si se trata de una enfermedad progresiva que lleva a la muerte prematura, carece de alternativas efectivas y afecta a un número reducido de pacientes58.
- DISCUSIÓN
Las actuales políticas sobre EERR se encuentran en una disyuntiva que no acaba de satisfacer a ninguna de las partes. Por un lado, los decisores se enfrentan al dilema de guiarse por criterios de eficiencia o facilitar el acceso a medicamentos esenciales a pacientes en peligro sin alternativas8. Por otro lado, las empresas se lamentan de que, a pesar de recibir incentivos públicos para desarrollar un nuevo fármaco, el reembolso del producto resultante no siempre es aprobado. Finalmente, los pacientes se quejan de sufrir restricciones de acceso a un tratamiento que en realidad existe.
Cómo decidir la financiación pública de los MMHH es un tema que también divide a la comunidad científica. Así, los decisores deben tratar de buscar un equilibrio entre las necesidades individuales de los pacientes y la asignación optima de recursos.
Para apoyar esta toma de decisiones, distintos autores han planteado la articulación de una serie de procesos de decisión multi-criterio que plasmen las preferencias sociales, y que se repasan en esta apartado de discusión.
Por otro lado, también resumiremos los distintos instrumentos alternativos de financiación de los que se valen los decisores en el ámbito de los MMHH para disponer de más recursos financieros, proteger financieramente a pacientes y a pequeños proveedores y compartir riesgos con la industria.
ALTERNATIVAS PROPUESTAS EN LA LITERATURA PARA EVALUAR ECONÓMICAMENTE UN MH
Distintos trabajos han venido realizando propuestas más o menos concretas sobre cómo articular un sistema de decisión de financiación de un nuevo medicamento huérfano que valore otros criterios más allá del de coste-efectividad.
Las primeras propuestas, más abstractas, proponían la incorporación de ponderaciones sociales en el análisis, mientras que posteriormente las propuestas iban más encaminadas hacia métodos de evaluación multi-criterio, que ofrecen la oportunidad de incorporar todos los elementos relevantes de valor de los MMHH en la decisión de financiación de una manera estructurada, transparente y consistente71.
Un ejemplo del primer tipo de propuestas, menos sofisticadas, es la de Hughes, que en 2005 propuso que el acceso a un MH no se determinara en función de la medida estándar de Años de Vida ajustados por Calidad (AVAC) ganados, sino que los AVAC logrados se ponderasen por unos pesos específicos que reflejaran las preferencias sociales en función de la prevalencia de la enfermedad (rara y ultra-rara), especificando umbrales de aceptación no lineales (Figura 1) que incrementarían la probabilidad de aceptación de un medicamento ultra-huérfano23.
Figura 1. Utilidad ponderada por la prevalencia de la enfermedad rara
Ya entre los análisis de decisión multi-criterio, en 2012 Hughes-Wilson planteó uno en el cual un panel de expertos acordaría el precio del MH en base a la importancia relativa de una serie de criterios referentes a la rareza de la enfermedad, pero también a su severidad, alternativas terapéuticas, grado de innovación, aplicabilidad en otras indicaciones, complejidad manufacturera, nivel de investigación realizada, grado de incertidumbre y facilidades para su seguimiento (Tabla 5)30.
Tabla 5. Criterios propuestos para la evaluación de MMHH y correspondientes potenciales parámetr
Posteriormente, Paulden ideó un marco teórico de toma de decisiones de reembolso de los medicamentos huérfanos algo más sofisticado, donde se identificaron 19 posibles factores de decisión relacionados con el valor del MH, su coste de oportunidad y otras consideraciones, y en el que se tienen en cuenta tanto las preferencias del paciente como las de los clínicos y la sociedad en su conjunto, desde distintos enfoques sociales (regla de rescate, principio de igualdad, principio de derechos) (Figura 2)24.
Figura 2. Marco propuesto de ayuda a la toma de decisiones sobre MMHH
Wagner no sólo construyó una herramienta de decisión multi-criterio (EVIDEM) donde es posible aplicar a los medicamentos huérfanos una ponderación social específica adicional en función de las preferencias sociales, sino que presentó un ejemplo hipotético de la aplicación de dicho marco teórico, donde se reflejan las prioridades explícitas de la población, y que permitía ordenar las intervenciones por áreas terapéuticas (Figura 3)20.
Figura 3. Ejemplo hipotético de la aplicación del marco EVIDEM de MMHH
Finalmente, cabe destacar el trabajo empírico de Sussex, en el cual se recogieron las preferencias sociales de expertos clínicos y de pacientes sobre los ocho factores identificados como relevantes para la toma de decisiones de financiación de los medicamentos huérfanos (Tabla 6)72. Se puso de manifiesto que los representantes de los pacientes valoran en mayor grado el impacto social de la enfermedad y el tratamiento sobre la calidad de vida del paciente y de sus cuidadores informales.
Tabla 6. Peso atribuido por expertos y pacientes a los factores de decisión
Impacto de la EERR y necesidad médica no cubierta asociada
Impacto del nuevo medicamento
- Disponibilidad de opciones de tratamiento efectivo/
mejor tratamiento de soporte en ausencia del nuevo medicamento.
- Pronóstico de supervivencia con el actual estándar de
- Morbilidad y discapacidad clínica bajo el actual estándar de
- Impacto social de la enfermedad sobre la vida diaria del paciente y sus cuidadores najo el actual estándar de
- Innovación del tratamiento (avance científico del nuevo tratamiento y contribución al resultado del paciente).
- Evidencia de la eficacia clínica del tratamiento y su resultado sobre el
Expertos Pacientes
ESQUEMAS ALTERNATIVOS DE FINANCIACIÓN DE LOS MEDICAMENTOS HUÉRFANOS
Como hemos visto, los gobiernos de todos los países revisados han favorecido de una u otra manera el reembolso público de medicamentos huérfanos no coste- efectivos, y para ello se han valido de distintos esquemas de financiación que faciliten el acceso de los pacientes al tratamiento, manejen la falta de evidencia científica sobre el fármaco y contengan su impacto presupuestario.
Los acuerdos de riesgo compartido son un instrumento de financiación cada vez más utilizado en el contexto de los MMHH, en tanto que permite al financiador público compartir con la industria farmacéutica los riesgos asociados a los resultados del medicamento. Los acuerdos pueden dirigirse a compartir el riesgo en los resultados en salud o el riesgo económico, y cuentan con ventajas, pero también con inconvenientes56,73-76.
Para limitar el impacto presupuestario de los fármacos tanto sobre el sistema sanitario como sobre el paciente se han implementado distintos acuerdos con las
empresas farmacéuticas, como acuerdos de precio-volumen (sobre todo, en Francia y Bélgica, para restringir el tratamiento a la subpoblación diana49), acuerdos de retorno (se exige al laboratorio devolver parte de los ingresos si sus ventas exceden el objetivo fijado), acuerdos de tope máximo anual y acuerdos centrados en la utilización (a menudo con precios diferentes para distintos grupos de población)74,77.
Entre los acuerdos de riesgo compartido basados en los resultados de salud se encuentran los de garantía de devolución (si el paciente no responde, se suspende el tratamiento y el laboratorio devuelve el dinero), los de resultados en coste-efectividad y, fundamentalmente, los de resultados clínicos. Por ejemplo, en los esquemas «no cure, no pay», si el medicamento no logra curar, aliviar o reducir los síntomas como estaba previsto, el fabricante debe devolver el pago recibido, o parte del mismo. Este tipo de acuerdos también puede centrarse en la seguridad del fármaco, especialmente cuando la evidencia inicial es escasa.
Los acuerdos de riesgo compartido se aplican a los MMHH en el mundo anglosajón y también en países europeos como Italia, Francia, Alemania, Suecia, el Reino Unido, Escocia, Dinamarca y, de manera incipiente, en España33,76. En Italia, Holanda, Australia y Canadá, algunos de los acuerdos han estado sujetos a la participación de los pacientes en registros, que no solo permiten el seguimiento de la eficiencia y seguridad del fármaco sino que también favorecen la generación de evidencia científica de cara a posteriores estudios, siendo especialmente útiles en enfermedades ultra-raras45.
Asimismo, existen programas de asistencia a pacientes que permiten un acceso de urgencia a MMHH a aquellos pacientes no asegurados o infra-asegurados (p.ej por haber superado el límite de cobertura de su seguro privado) o un acceso rápido o expandido a aquellos pacientes participantes en ensayos clínicos. En EEUU estos programas han tenido un amplio recorrido y también son comunes en países asiáticos y latinoamericanos, pero no en Europa donde la cobertura pública y privada de la sanidad los hace innecesarios.
Finalmente, para favorecer el acceso de los pacientes a los MMHH, muchos países cuentan con fondos específicos. Por ejemplo, en el Reino Unido y Holanda han dotado un fondo nacional controlado de forma centralizada para mantener la equidad y evitar niveles inaceptables de riesgo de los proveedores más pequeños. Francia y Australia cuentan también con un presupuesto destinado específicamente a medicamentos huérfanos, de modo que éstos no tienen que competir con otras provisiones más generales.
- CONCLUSIONES
Algunos autores alertan de que el actual sistema de financiación pública de los MMHH es insatisfactorio para la industria, injusto para los pacientes e ineficiente para la sociedad en su conjunto, porque está incentivando a las empresas a desarrollarlos pero el posterior acceso a los mismos está limitado por restricciones presupuestarias10.
Se supone que los decisores sanitarios deberían realizar recomendaciones basadas en la evidencia que sean racionales, transparentes y predecibles, pero también socialmente responsables y que la sociedad considere legítimas y compatibles con sus restricciones económicas, morales, sociales, legales y políticas.
Al igual que se utilizan las preferencias sociales para no financiar públicamente algunos tratamientos coste-efectivos poco valorados socialmente, como la eliminación de tatuajes, existen otras intervenciones, como los MMHH, con rangos de coste- efectividad por encima de los umbrales estándares que sin embargo la sociedad puede estar dispuesta a financiar por otros motivos10.
En la primera parte de este trabajo hemos revisado la literatura teórica sobre este debate, comprobando que la mayoría de estudios aboga por utilizar otros criterios más allá del de coste-efectividad en la decisión de reembolso de los MMHH, y hemos identificado los tres principales bloques de criterios adicionales (humanísticos, clínicos y económicos) que más se mencionan en la literatura.
En la segunda parte hemos indagado sobre cómo se aplican estos criterios en la práctica real de los principales países desarrollados. Comprobamos que ninguno de ellos considera la eficiencia como único criterio de decisión, sino que tienen en cuenta otros factores, siendo los más comunes la gravedad de la enfermedad, la no disponibilidad de alternativas y la magnitud del impacto presupuestario.
No hay consenso sobre si los criterios humanísticos deberían ser considerados o no en la decisión de financiación. La corriente igualitarista defiende el principio ético de solidaridad y no abandono por encima de las restricciones presupuestarias, mientras que los utilitaristas creen que reembolsar un tratamiento no coste-efectivo es ineficiente para la sociedad, por lo que rechazan los criterios humanísticos. La mayoría de autores sí coindice, en cambio, en oponerse a la utilización del concepto de rareza per se de una manera aislada. Los argumentos humanísticos son tenidos en cuenta, al menos implícitamente, en la práctica real de muchos de los países revisados, destacando el papel de la regla de rescate y del principio de equidad en el acceso.
Respecto a los criterios clínicos —severidad de la enfermedad, disponibilidad de alternativas, modificación del curso de la enfermedad—, aunque algunos autores reniegan de su importancia específica en el ámbito de los huérfanos, la gran mayoría de países revisados los tienen en cuenta en la decisión final de financiación.
Los argumentos económicos asociados a los medicamentos huérfanos con considerados en la mayoría de países revisados. Algunos no sólo contemplan la magnitud del impacto presupuestario del medicamento, sino su impacto socioeconómico o incluso el impacto de todos los MMHH financiados públicamente. Los países se valen de distintos instrumentos de financiación para favorecer el acceso a este tipo de fármacos y compartir riesgos.
Por lo tanto, la evaluación económica estándar es una herramienta más que el gestor debe tener en cuenta en el proceso de toma de decisiones sobre MMHH, pero no la única. Debe plantearse qué otros criterios considerar para conciliar la sostenibilidad del sistema sanitario con las preferencias de la sociedad, teniendo en cuenta otros posibles criterios, tales como su efectividad relativa, su grado de innovación, su necesidad médica o su viabilidad económica de una manera individualizada, además de otros posibles aspectos como la igualdad, la equidad y la solidaridad.
Se han publicado distintas propuestas de articulación del proceso de financiación/ reembolso de los medicamentos huérfanos, muchas de ellas combinando un enfoque deliberativo con uno algorítmico que pondere los distintos criterios a considerar. También se han puesto en marcha otro tipo de iniciativas, como por ejemplo la publicación de una guía metodológica de evaluación económica aplicada a los medicamentos huérfanos en España, que plantea la utilización de criterios adicionales al de eficiencia78. En cualquier caso, sería deseable profundizar en la investigación sobre las preferencias sociales existentes en el ámbito de los medicamentos huérfanos en España, en línea con algunos ejercicios empíricos realizados en otros países.
Confiamos en que este estudio sirva de ayuda a los decisores sanitarios, facilitándoles la identificación y contextualización de los diferentes criterios que es posible aplicar a la decisión de financiación de los huérfanos. Se trata de un área de creciente interés, dado el auge esperado en la comercialización de este tipo de medicamentos. Las terapias dirigidas y la medicina personalizada supondrán nuevos retos que será necesario abordar, ya que los mayores beneficios clínicos vendrán de la mano de una mayor exigencia de recursos. Otros países ya se han puesto manos a la obra.
REFERENCIAS BIBLIOGRÁFICAS
- European Parliament and the Council of the European Union, B. Regulation (EC) No 141/2000 of the European Parliament and the Council of 16 December 1999 on orphan medicinal products. Official Journal of the European Communities 18, 69 (2000).
- Institute of Medicine (US) Committee on Accelerating Rare Diseases Research and Orphan Product Development. Rare Diseases and Orphan Products: Accelerating Research and Development. (National Academies Press (US), 2010).
- EURORDIS Rare Diseases Europe. Sobre las enfermedades raras. at <http://www.eurordis.org/es/enfermedades-raras>.
- EURORDIS European Organisation for Rare Diseases. Rare Diseases: understanding this public health priority. (2005). at <http://link.springer.com/content/pdf/10.1007/978-3-662-43680-6.pdf>.
- Federación Española de Enfermedades Raras (FEDER). Estudio sobre la situación de necesidades sociosanitarias de las personas con enfermedades raras en España. Estudio ENSERio. (2009).
- Simoens, S. Pricing and reimbursement of orphan drugs: the need for more transparency. Orphanet J Rare Dis 6, 1172-1176 (2011).
- Drummond, M. F. Challenges in the economic evaluation of orphan drugs. Eurohealth 14, 16-7 (2008).
- Drummond, M. & Towse, A. Orphan drugs policies: a suitable case for treatment. The European Journal of Health Economics 15, 335-340 (2014).
- European Medicines Agency. Record number of medicines for rare diseases recommended for approval in 2014. News and events (2015). at <http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_ events/news/2015/01/news_detail_002247.jsp&mid=WC0b01ac058004d5c1>.
- Karst, K. FDA Law Blog: The 2014 Numbers Are In: FDA’s Orphan Drug Program Shatters Records. (2015).
- McCabe, C., Claxton, K. & Tsuchiya, A. Orphan drugs and the NHS: should we value rarity? BMJ: British Medical Journal 331, 1016 (2005).
- McCabe, C. Orphan drugs revisited. QJM 99, 341-345 (2006).
- McCabe, , Tsuchiya, A, Claxton, K & Raftery, J. Assessing the economic challenges posed by orphan drugs: A comment on Drummond et al. International Journal of Technology Assessment in Health Care 23, 397-401 (2007).
- Simoens, S., Cassiman, D., Dooms, M. & Picavet, E. Orphan Drugs for Rare Diseases: Is it Time to Revisit Their Special Market Access Status? Drugs 72, 1437-1443 7p (2012).
- Desser, A. S. et al. Societal views on orphan drugs: cross sectional survey of Norwegians aged 40 to 67. BMj 341, (2010).
- Drummond, M. F., Wilson, D. A., Kanavos, P., Ubel, P. & Rovira, J. Assessing the economic challenges posed by orphan drugs. International journal of technology assessment in health care 23, 36-42 (2007).
- Hyry, H. I., Roos, J. C., Manuel, J. & Cox, T. M. The legal imperative for treating rare disorders. Orphanet J Rare Dis 8, 135 (2013).
- Picavet, E., Dooms, M., Cassiman, D. & Simoens, S. Orphan drugs for rare diseases: grounds for special status. Drug Development Research 73, 115-119 (2012).
- Burls, , Austin, D. & Moore, D. Commissioning for rare diseases: view from the frontline. BMJ 331, 1019-1021 (2005).
- Wagner, M., Khoury, H., Willet, J., Rindress, D. & Goetghebeur, M. Can the EVIDEM Framework Tackle Issues Raised by Evaluating Treatments for Rare Diseases: Analysis of Issues and Policies, and Context-Specific Adaptation. PharmacoEconomics 1-17 (2015).
- Tambuyzer, E. Rare diseases, orphan drugs and their regulation: questions and misconceptions. Nature Reviews Drug Discovery 9, 921-929 (2010).
- Reidenberg, M. M. Are drugs for rare diseases ‘essential’? World Health Organization. Bulletin of the World Health Organization 84, 686 (2006).
- Hughes, D. A. Drugs for exceptionally rare diseases: do they deserve special status for funding? QJM 98, 829-836 (2005).
- Paulden, M., Stafinski, T., Menon, D. & McCabe, C. Value-Based Reimbursement Decisions for Orphan Drugs: A Scoping Review and Decision Framework. PharmacoEconomics 33, 255-269 (2015).
- Gosain, S. Consideration for Rare Diseases in the Context of Drug Reimbursement Processes. (University of Ottawa, 2015). at <http://www.ruor.uottawa.ca/handle/10393/32434>.
- Hyry, H. I., Stern, A. D., Cox, T. M. & Roos, J. C. P. Limits on use of health economic assessments for rare diseases. QJM 107, 241-245 (2014).
- Juth, N. For the Sake of Justice: Should We Prioritize Rare Diseases? Health Care Analysis 1-20 (2014).
- Desser, A. S. Prioritizing treatment of rare diseases: A survey of preferences of Norwegian doctors. Social Science & Medicine 94, 56-62 (2013).
- Desser, A. S., Olsen, J. A. & Grepperud, S. Eliciting Preferences for Prioritizing Treatment of Rare Diseases: the Role of Opportunity Costs and Framing Effects. PharmacoEconomics 31, 1051-61 (2013).
- Hughes-Wilson, W., Palma, A., Schuurman, A. & Simoens, S. Paying for the Orphan Drug System: break or bend? Is it time for a new evaluation system for payers in Europe to take account of new rare disease treatments. Orphanet J Rare Dis 7, 74 (2012).
- Largent, E. A. & Pearson, S. D. Which orphans Will Find a home? The rule of rescue in resource allocation for rare diseases. The Hastings Center Report 42, 27-34 (2012).
- Mentzakis, , Stefanowska, P. & Hurley, J. A discrete choice experiment investigating preferences for funding drugs used to treat orphan diseases: an exploratory study. Health Economics, Policy and Law 6, 405-433 (2011).
- Barak, A. & Shankar Nandi, J. Orphan drugs: pricing, reimbursement and patient access. International Journalof Pharmaceutical and Healthcare Marketing 5, 299-317 (2011).
- Denis, A., Mergaert, L., Fostier, C., Cleemput, I. & Simoens, S. Issues Surrounding Orphan Disease and Orphan Drug Policies in Europe. Applied Health Economics and Health Policy 8, 343-50 (2010).
- Campillo, C & Peiró, S. Enfermedades raras, medicamentos huérfanos: el valor de la orfandad. GCS 42, 119-127 (2009).
- Miles, K. , Packer, C. & Stevens, A. Quantifying emerging drugs for very rare conditions. QJM 100, 291-295 (2007).
- Hughes, D. Rationing of drugs for rare diseases. Pharmacoeconomics 24, 315-316 (2006).
- Dear, J. W., Lilitkarntakul, P. & Webb, D. J. Are rare diseases still orphans or happily adopted? The challenges of developing and using orphan medicinal products. British Journal of Clinical Pharmacology 62, 264-271 (2006).
- Stolk, P., Willemen, M. J. & Leufkens, H. G. ‘Rare essentials’: drugs for rare diseases as essential medicines. World Health Organization. Bulletin of the World Health Organization 84, 745-751 (2006).
- NICE (National Institute for Clinical Excellence). NICE Citizens Council Report: Ultra Orphan drugs. (2004). https://www.nice.org.uk/Media/Default/Get-involved/Citizens-Council/Reports/CCReport04UltraOrphanDrugs.pdf
- Jonsen, A. R. Bentham in a box: technology assessment and health care allocation. Med. & Health Care 14, 172 (1986).
- McKie, J. & Richardson, J. The rule of rescue. Social science & medicine 56, 2407-2419 (2003).
- Picavet, E., Cassiman, D. & Simoens, S. Reimbursement of orphan drugs in Belgium: what (else) matters? Orphanet journal of rare diseases 9, 1-9 (2014).
- Gammie, T., Lu, C. Y. & Babar, Z. U.-D. Access to Orphan Drugs: A Comprehensive Review of Legislations, Regulations and Policies in 35 Countries. PLOS ONE 10, e0140002 (2015).
- Garau, M. & Mestre-Ferrandiz, J. Access mechanisms for orphan drugs: a comparative study of selected European countries. OHE briefing 52, 1-24 (2009).
- Pryde, D. C. & Palmer, M. J. Orphan Drugs and Rare Diseases. (Royal Society of Chemistry, 2014).
- Dupont, A. G. & Van Wilder, P. B. Access to orphan drugs despite poor quality of clinical evidence. British Journalof Clinical Pharmacology 71, 488-496 (2011).
- European Medicines Agency. European public assessment reports. At: <http://www.ema.europa.eu/ema/jsp?curl=pages/medicines/landing/epar_search.jsp&mid=WC0b01ac058001d125>.
- Tordrup, D., Tzouma, V. & Kanavos, P. Orphan drug considerations in Health Technology Assessment in eight European countries. Rare Diseases and Orphan Drugs: An International Journal of Public Health 1, 86-97 (2014).
- Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. BOE núm. 177.
- Real Decreto-Ley 9/2011, de 19 de agosto, de medidas para la mejora de la calidad y cohesión del sistema nacional de salud. BOE núm. 200.
- Espín, J., Oliva, J. & Rodríguez-Barrios, J. M. Esquemas innovadores de mejora del acceso al mercado de nuevas tecnologías: los acuerdos de riesgo compartido. Gaceta Sanitaria 24, 491-497 (2010).
- Rémuzat, , Toumi, M. & Falissard, B. New drug regulations in France: what are the impacts on market access? Part 1 - Overview of new drug regulations in France. Journal of Market Access & Health Policy 1, (2013).
- Denis, A., Mergaert, L., Fostier, C., Cleemput, I. & Simoens, S. A comparative study of European rare disease and orphan drug markets. Health Policy 97, 173-179 (2010).
- Belgian Health Care Knowledge Centre. KCE reports 112C (2009). Policies for Orphan Diseases and Orphan Drugs (2009).
- Morel, T. et al. Reconciling uncertainty of costs and outcomes with the need for access to orphan medicinal products: a comparative study of managed entry agreements across seven European countries. Orphanet J Rare Dis 8, 198 (2013).
- Denis, A. et al. Critical Assessment of Belgian Reimbursement Dossiers of Orphan Drugs. PharmacoEconomics 29, 883-93 (2011).
- Houses of Parliament. Value Based Assessment of Drugs. PostNote 487 (2015).
- George, , Harris, A. & Mitchell, A. Cost-Effectiveness Analysis and the Consistency of Decision Making: Evidence from Pharmaceutical Reimbursement in Australia (1991 to 1996). PharmacoEconomics 19, 1103-1109 (2001).
- Rosenberg-Yunger, Z. R. S., Daar, A. S., Thorsteinsdóttir, H. & Martin, D. K. Priority setting for orphan drugs: An international comparison. Health Policy 100, 25-34 (2011).
- Cookson, R., McCabe, C. & Tsuchiya, A. Public healthcare resource allocation and the Rule of Rescue. Journalof Medical Ethics 34, 540-544 (2008).
- Laupacis, A. Economic Evaluations in the Canadian Common Drug Review. Pharmacoeconomics 24(11): 1157-62 (2006).
- Clarke, J. T. R., Amato, D. & Deber, R. B. Managing public payment for high-cost, high-benefit treatment: enzyme replacement therapy for Gaucher’s disease in Ontario. CMAJ 165, 595-596 (2001).
- Hadorn, D. The Oregon Priority-setting Exercise Cost-Effectiveness and the Rule of Rescue, Revisited. Medical Decision Making 16, 117-119 (1996).
- Scottish Medicines Consortium SMC Modifiers used in Appraising New Medicines. at <https://www. org.uk/About_SMC/Policy_statements/SMC_Modifiers_used_in_Appraising_New_ Medicines>.
- Persson, U. Value based pricing in Sweden: Lessons for design? Office of Health Economics (2012).
- Panju, A. H. & Bell, C. M. Policy alternatives for treatments for rare diseases. CMAJ 182, E787-E792 (2010).
- Lamb, E. J. Rationing of medical care: rules of rescue, cost-effectiveness, and the Oregon plan: Presidential Address. American journal of obstetrics and gynecology 190, 1636-1641 (2004).
- Abellán, JM. Utilización de AVAC en diferentes situaciones clínicas. (2011).
- Australian Government Department of Health. Life Saving Drugs Program Criteria and Conditions. at <http://www.health.gov.au/internet/main/publishing.nsf/Content/lsdp-criteria>.
- Gutierrez, L., Patris, J., Hutchings, A. & Cowell, W. Principles for consistent value assessment and sustainable funding of orphan drugs in Europe. Orphanet Journal of Rare Diseases 10, (2015).
- Sussex, J. et al. A pilot study of multicriteria decision analysis for valuing orphan medicines. Value in Health 16, 1163-1169 (2013).
- Cook, R. L. et al. Factors associated with initiation and completion of human papillomavirus vaccine series among young women enrolled in Medicaid. The Journal of adolescent health: official publication of the Society for Adolescent Medicine 47, 596-9 (2010).
- Puig-Junoy, J. & Meneu, R. Aplicación de los contratos de riesgo compartido a la financiación de nuevos medicamentos. Ges Clin Sanit 7, 88-94 (2005).
- Campillo-Artero, C., Del Llano, J. & Poveda, J. L. Contratos de riesgo compartido, ¿con medicamentos huérfanos? Farmacia Hospitalaria 36, (2012).
- Stafinski, T., McCabe, C. J. & Menon, D. Funding the unfundable: mechanisms for managing uncertainty in decisions on the introduction of new and innovative technologies into healthcare systems. Pharmacoeconomics 28(2): 113-142 (2010).
- Guía para la definición de criterios de aplicación de esquemas de pago basados en resultados en el ámbito farmacoterapéutico (acuerdos de riesgo compartido). (2014).
- Zozaya, N, Villoro, R, Hidalgo, A, Sanz, A & Grupo de Expertos RADEEV. Guía metodológica de evaluación económica aplicada a medicamentos huérfanos: recomendaciones del grupo de expertos RADEEV. (Instituto Max Weber, 2015).














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: