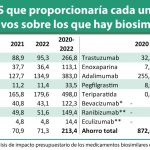
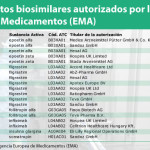
La página web del Centro Nacional de Información Biotecnológica de Estados Unidos, dependiente del National Instutes for Health (NIH), ha hecho público un trabajo liderado por Hillel P. Cohen, director ejecutivo de Asuntos Científicos de Sandoz, y en el que también han participado investigadores del Oregon Medical Research Center, Rocky Mountain Cancer Centers, IBD Center - Humanitas Clinical and Research Hospital, y de Avalere Health, titulado 'Switching Reference Medicines to Biosimilars: A Systematic Literature Review of Clinical Outcomes'. Se trata de una revisión de 90 estudios con datos primarios, sacados de las plataformas Medline y Embase, con información sobre eficacia y seguridad en relación con el intercambio de medicamentos biológicos de referencia por biosimilares.
En total, se identificaron 90 estudios, realizados entre 1993 y junio de 2017 sobre siete moléculas de diferente nivel de complejidad y dirigidas a 14 enfermedades. Como conclusión, los autores apuntan que en la gran mayoría de ellos no se detectaron diferencias en eficacia, seguridad e inmunogenicidad al llevar a cabo esta práctica. "Las señales relacionadas con la seguridad que se percibieron en el intercambio fueron las mismas que las que se conocen para el uso continuado de los medicamentos biológicos de referencia", apuntan los autores.
Éstos afirman que la información acumulada hasta la fecha en relación con el intercambio de un producto por el otro sugiere que éste "no lleva implícito ningún peligro por sí mismo". Opinan, por este motivo, "que los pacientes, los profesionales sanitarios y la sociedad en general no debería concebir esta práctica como algo problemático".
La importancia de la farmacovigilancia
Además, recuerdan que, como ocurre con los biológicos de referencia, la farmacovigilancia continuada es clave para monitorizar eventos adversos poco comunes o cambios inesperados en la eficacia y la seguridad de estos productos como consecuencia de los cambios en su producción. A este respecto, concluyen que "la farmacovigilancia aplicada a todos los medicamentos biológicos debería incrementar la confianza de todos los agentes en los biosimilares, siendo así motor de aceptación de estas medicinas efectivas y seguras".
Junto a esta visión más general, los autores hacen alusión, además, a los datos de tres estudios sobre multi-switch, uno con filgrastim, otro con etanercept y otro con adalimumab, en los que, frente a las reservas que suelen expresarse en relación con esta práctica, tampoco se habrían relatado diferentes en lo que respecta a la eficacia y seguridad tras encadenar cinco, tres y cuatro intercambios, respectivamente.






















 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: