 GUÍA DE MEDICAMENTOS BIOSIMILARES PARA FARMACÉUTICOS (acceda a la misma en formato PDF)
GUÍA DE MEDICAMENTOS BIOSIMILARES PARA FARMACÉUTICOS (acceda a la misma en formato PDF)
Enero 2019
BioSim - Asociación Española de Biosimilares. Calle Condesa de Venadito, 1 28027 - Madrid. Teléfono: +34 91 864 31 32 www.biosim.es | info@biosim.es
ISBN: 978-84-09-08592-7. Depósito legal: M-3513-2019
ÍNDICE
Objetivo de esta guía....................................................................................... 4
¿Qué son los medicamentos biológicos?......................................................... 4
¿Qué son los medicamentos biosimilares?...................................................... 5
Los medicamentos biosimilares no son genéricos............................................ 5
¿Qué medicamentos biosimilares hay autorizados actualmente en la Unión Europea? ¿Y en España?............................................................................................... 6
¿Cómo se aprueba un medicamento biosimilar?.............................................. 7
¿Qué fundamento científico sustenta la aprobación de los medicamentos biosimilares?........................................................................................................ 8
Cuando un medicamento biológico original cambia su proceso de producción, ¿qué aspectos se comprueban? ¿Qué variabilidad presentan los distintos lotes de un medicamento biológico?................................. 14
¿Qué es la extrapolación de indicaciones?....................................................... 16
¿Existe un mayor riesgo de inmunogenicidad asociado al uso de biosimilares? 17
¿Cabe esperar mayores reacciones adversas con el medicamento biosimilar que con el medicamento original o de referencia?................................................. 18
¿Ofrecen los medicamentos biosimilares las mismas garantías sobre calidad, eficacia y seguridad que los medicamentos de referencia?............................. 19
Como farmacéutico, ¿cómo puedo contribuir a la eficacia del medicamento y a la seguridad del paciente tratado con medicamentos biosimilares?................. 21
¿Cuál es el ámbito de dispensación de los medicamentos biosimilares autorizados y comercializados en España actualmente?..................................................... 22
¿Qué vienen a aportar los medicamentos biosimilares?.................................. 23
¿Establece la Agencia Europea del Medicamento directrices en cuanto a intercambiabilidad (cambio o sustitución) de medicamentos biológicos, originales o biosimilares?............................................................................................. 25
Como farmacéutico, ¿puedo sustitutir un medicamento de referencia por un biosimilar o un biosimilar por el medicamento de referencia en el acto de la dispensación? 25
¿Cuál pretende ser la aportación de BioSim para promover un mejor conocimiento y potenciar una información científica y rigurosa a todos los profesionales sanitarios?............................................................... 26
Glosario de términos frecuentemente utilizados al hablar de biosimilares........ 27
Anexo 1. Medicamentos biosimilares autorizados por la CE............................ 30
Anexo 2. Medicamentos biosimilares autorizados por la AEMPS..................... 32
Bibliografía................................................................................................... 33
(acceda a la Guía de Biosmilares para farmacéuticos en formato PDF)
Objetivo de esta guía
El objetivo fundamental de la Guía de Medicamentos Biosimilares para Farmacéuticos es aportar un documento que sirva como referente a todos los farmacéuticos, sea cual sea su actividad profesional o modalidad de ejercicio profesional, y les aporte los conocimientos esenciales de los principios farmacológicos y de regulación de los medicamentos biosimilares, así como su contribución a la sostenibilidad del Sistema Nacional de Salud (SNS).
¿Qué son los medicamentos biológicos?
Los medicamentos biológicos son aquellos medicamentos que contienen uno o más principios activos producidos o derivados de una fuente biológica de origen recombinante o extractivo, entre los que se incluyen un amplio abanico de productos como vacunas, anticuerpos poli y monoclonales, hemoderivados, alérgenos, terapias celulares, terapias génicas, y proteínas recombinantes, con actividad biológica e indicaciones terapéuticas reconocidas1 . La composición química de los medicamentos biológicos es muy variada, pudiendo incluir proteínas, hidratos de carbono, ácidos nucleicos, o combinaciones de estas sustancias, o incluso estar formados por seres vivos completos, como células o tejidos. Los medicamentos biológicos pueden obtenerse de múltiples fuentes naturales: humanos, animales o microorganismos2 .
Los medicamentos biotecnológicos son medicamentos de origen biológico, pero con la particularidad de que se obtienen a partir de líneas celulares modificadas genéticamente mediante técnicas de ingeniería genética. Muchos de los medicamentos biológicos que tradicionalmente se obtenían de fuentes biológicas sin modificar, ahora son de origen biotecnológico, como por ejemplo la insulina, la hormona del crecimiento o las eritropoyetinas, entre otros.
¿Qué son los medicamentos biosimilares?
Según la Agencia Europea del Medicamento (EMA), un biosimilar es un medicamento biológico que contiene una versión del principio activo de un producto biológico original3 o producto de referencia, cuya exclusividad en el mercado ha expiradoa , y frente al cual demuestra biosimilitud. Esta demostración se realiza a través de un exhaustivo ejercicio de comparabilidad que concluye que las pequeñas diferencias fisicoquímicas y biológicas que existen no afectan a la eficacia y seguridad, lo que en última instancia permite su autorización como biosimilar. Es importante reseñar que el término biosimilar tiene un carácter regulatorio y se utiliza en la Unión Europea (UE) para evidenciar la comparabilidad entre el biológico de referencia y el biosimilar.
Tras superar satisfactoriamente los ensayos clínicos en la indicación o indicaciones más sensibles, se extrapolan al biosimilar aquellas otras indicaciones del medicamento original que los evaluadores consideran oportuno a la vista de los resultados del ejercicio de comparabilidad entre original y biosimilar.
Los medicamentos biosimilares no son genéricos
Es necesario resaltar la diferencia que existe entre medicamentos genéricos y biosimilares, pues de ella se derivan las diferencias en los requerimientos regulatorios a los que son sometidos por parte de las agencias reguladoras. Un genérico es una sustancia de síntesis química con una estructura que se puede caracterizar de forma completa, por lo que es posible garantizar que el principio activo que contiene un medicamento genérico es idéntico al del medicamento original4. Esto no ocurre con los medicamentos biológicos en general, y con los biotecnológicos en particular. Los medicamentos biológicos son sustancias complejas, de gran tamaño y sujetas a una variabilidad fisicoquímica inherente a todo proceso de producción en el que participan seres vivos. Por ello, los medicamentos biosimilares son versiones altamente similares del principio activo del producto de referencia, las cuales pueden presentar pequeñas diferencias estructurales con el medicamento de referencia que deben ser caracterizadas. Por consiguiente, se necesitan más estudios para la aprobación de un biosimilar que para la de un genérico, a fin de poder garantizar que las pequeñas diferencias no afectan a la eficacia ni a la seguridad del medicamento. Esta variabilidad fisicoquímica es inherente a la fabricación de productos de naturaleza biológica, y puede aparecer de hecho en cualquier medicamento biológico, debido a cambios en su proceso de fabricación, ya sea este original o biosimilar.
Cualquier medicamento está protegido por diferentes patentes sobre varios aspectos y propiedades del producto durante 20 años. La cuestión es que varios de estos años (aproximadamente la mitad) se consumen durante las etapas preclínicas y clínicas del desarrollo del producto, antes de que este llegue al mercado. Los certificados complementarios de protección (CCPs) garantizan hasta cinco años más de protección adicional de la patente de medicamentos. También se puede generar una protección adicional de la “Exclusividad de Datos” del producto innovador durante un periodo determinado, lo que garantiza la exclusividad en el mercado del medicamento original.
¿Qué medicamentos biosimilares hay autorizados actualmente en la Unión Europea? ¿Y en España?
Hace ya más de una década que fue aprobado el primer biosimilar en la UE, la hormona del crecimiento, en 2006. A fecha de enero de 2019, en la UE, hay 53 medicamentos biosimilares de 16 principios activos5 (adalimumab, bevacizumab, enoxaparina sódica, epoetina alfa, epoetina zeta, etanercept, filgrastim, folitropina alfa, infliximab, insulina glargina, insulina lispro, pegfilgrastim, rituximab, somatropina, teriparatida y trastuzumab) aprobados por la Comisión Europea (CE) mediante procedimiento centralizado ( Anexo 1 ) . ( Para actualizar esta información visitar el link de la Agencia Europea del Medicamento: https://www.ema.europa.eu/en/medicines/field_ema_web_categories%253Aname_field/Human/ema_group_types/ema_medicine/field_ema_med_status/auth orised-36/ema_medicine_types/field_ema_med_biosimilar).
Como se desarrolla en la siguiente pregunta, sólo los medicamentos biotecnológicos tienen la obligación de ser aprobados por la CE, por lo que algunos medicamentos aprobados en España no aparecerán como aprobados en la web de la EMA. A nivel nacional, se cuenta con 38 medicamentos biosimilares autorizados, de 15 principios activos y de los cuales hay 26 comercializados a fecha de enero de 2019. (Para actualizar esta información visitar el link de l a Agencia Española de Medicamentos y Productos Sanitarios: https://www.aemps.gob.es/cima/publico/lista.html).
¿Cómo se aprueba un medicamento biosimilar?
Todos los medicamentos susceptibles de comercialización en los Estados miembros de la UE han de pasar previamente por la evaluación de las agencias de medicamentos, ya sea bajo la coordinación europea de la EMA o directamente por las agencias nacionales de cada país (la Agencia Española de Medicamentos y Productos Sanitarios, AEMPS, en el caso de España). Respecto a la vía regulatoria, existen cuatro vías de autorización o de registro: centralizada, de reconocimiento mutuo, descentralizada y nacional. En el caso de los medicamentos de origen biotecnológico, originales o biosimilares, estos han de autorizarse siempre por la vía centralizada, es decir, un único expediente de registro es presentado a la EMA y es evaluado por el Comité de Medicamentos de Uso Humano (CHMP) del que forman parte los representantes de las agencias nacionales. Cuando el CHMP emite una opinión favorable, la CE será la encargada de autorizar la comercialización del fármaco, quedando este autorizado automáticamente en todo el territorio europeo. En el caso de los medicamentos biosimilares no biotecnológicos, la vía puede ser centralizada, de reconocimiento mutuo, descentralizada o nacional, según los intereses particulares de cada laboratorio en cada Estado miembro. Es importante resaltar que la gran mayoría de los principios activos para los cuales existen medicamentos biosimilares autorizados en la UE son de origen biotecnológico y todos, excepto en la actualidad las heparinas de bajo peso molecular y el condroitín sulfato, han sido aprobados por la vía centralizada desde la CE.
En España, además, previo a su comercialización debe ser emitida una resolución favorable de financiación con cargo al SNS por parte del Ministerio de Sanidad, Consumo y Bienestar Social y, en su caso, ser fijado el precio por parte de la Comisión Interministerial de Precios.
¿Qué fundamento científico sustenta la aprobación de los medicamentos biosimilares?
Antes de obtener la autorización de comercialización, los medicamentos biosimilares han debido pasar una exhaustiva evaluación científica. Esta se basa en un ejercicio de comparabilidad que permite demostrar la biosimilitud entre el biosimilar y su medicamento de referencia. El concepto científico de comparabilidad está claramente establecido por la EMA6,7, y consiste en probar que no existen diferencias significativas entre el medicamento biosimilar y su biológico de referencia mediante pruebas fisicoquímicas y de actividad biológica altamente sensibles. Para ello, la EMA ha elaborado una serie de guías o directrices, algunas son generales, de aplicación a todos los biosimilares, y otras son específicas, para cada producto (Tabla 1).
Tabla 1. Directrices elaboradas por la EMA sobre medicamentos biosimilares
| TIPO DE DIRECTRICES | NUMERO DE REFERENCIA | FECHA DE PUBLICACIÓN |
| DIRECTRICES GENERALES | ||
| Similar biological medicinal products | CHMP/437/04 Rev. 1 | 29/10/2014 |
| Similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues | EMEA/CHMP/BMWP/42832/2005 Rev. 1 | 09/01/2015 |
| Similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues | CHMP/BWP/247713/2012 | 03/06/2014 |
8
| TIPO DE DIRECTRICES | NUMERO DE REFERENCIA | FECHA DE PUBLICACIÓN |
| DIRECTRICES ESPECIFICAS | ||
| Biosimilar medicinal products containing recombinant granulocyte-colony stimulating factor (Annex to guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues) | EMEA/CHMP/BMWP/31329/2005 | 22/02/2006 |
| Non-clinical and clinical development of similar biological medicinal products containing low-molecular-weight heparins | EMEA/CHMP/BMWP/118264/2007 Rev. 1 | 24/11/2016 |
| Non-clinical and clinical development of similar biological medicinal products containing recombinant human insulin and insulin analogues | EMEA/CHMP/BMWP/32775/2005 Rev. 1 | 11/03/2015 |
| Similar biological medicinal products containing interferon beta | EMA/CHMP/BMWP/652000/2010 | 06/03/2013 |
| Similar biological medicinal products containing monoclonal antibodies: non- clinical and clinical issues | EMA/CHMP/BMWP/403543/2010 | 15/06/2012 |
| Similar biological medicinal products containing recombinant erythropoietins | EMEA/CHMP/BMWP/301636/08 | 14/04/2010 |
| Similar biological medicinal products containing recombinant follicle- stimulating hormone | CHMP/BMWP/671292/2010 | 06/03/2013 |
| Similar medicinal products containing somatropin (Annex to guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues) | EMEA/CHMP/BMWP/94528/2005 | 22/02/2006 |
9
El ejercicio de comparabilidad se lleva a cabo en varias etapas8:
Etapa de comparabilidad fisicoquímica: se realizan ensayos físico-químicos mediante técnicas analíticas para garantizar la biosimilitud estructural entre ambos medicamentos (medicamento biológico original y medicamento biosimilar). La Tabla 2 detalla algunas de las técnicas empleadas en función del atributo que se desea comparar.
Tabla 2. Técnicas analíticas empleadas en la etapa de comparabilidad fisicoquímica
(adaptado de9 )
| ATRIBUTO ANALIZADO | TÉCNICA ANALÍTICA |
| Estructura primaria | · Absortividad molar · Mapeo de péptidos |
| Estructuras de orden superior | · Análisis de puentes disulfuro · Análisis de grupos tiol libres · Espectrometría infrarroja por Transformadas de Fourier |
| Contenido | · Concentración de proteínas |
| Pureza (agregados y fragmentos) | · Ultracentrifugación analítica · Cromatografía capilar · Cromatografía de exclusión por tamaño |
| Isoformas (variantes de carga) | · Cromatografía de intercambio iónico · Isoelectroenfoque |
| Glicosilación | · Perfil de oligosacáridos · Determinación de N-Glicanos · Análisis de Ácido Siálico |
Etapa de comparabilidad de la actividad biológica: se realizan ensayos preclínicos, que incluyen estudios in vitroa, ex vivob y, cuando se estimen necesarios,
- in vitro: se refiere a una técnica para realizar un determinado experimento en un tubo de ensayo, o generalmente en un ambiente controlado fuera de un organismo
- ex vivo: se refiere al procedimiento diagnóstico o experimento que se realiza en tejidos o células vivas, que han sido extraídas del organismo, pero que se mantienen vivas en un medio
10
in vivoc, para comparar la actividad biológica del medicamento de referencia y el biosimilar mediante una batería de bioensayos que permiten caracterizar las funciones biológicas más relevantes para su acción terapéutica y su toxicidad (p. ej. unión a receptores o a sus dianas biológicas, transducción de señales biológicas, viabilidad celular).
La demostración de una actividad biológica comparable debe preceder a la comparación clínica de ambos productos. A modo de ejemplo y para conocer la exhaustividad de estos estudios, las Tablas 3 y 4 describen, respectivamente, los ensayos de actividad in vitro y ex vivo más habituales para la valoración de la actividad biológica de insulinas y de anticuerpos monoclonales anti-TNF.
Tabla 3. Ensayos de actividad biológica comúnmente usados para estudios de comparabilidad entre insulinas o análogos de la insulina
| INSULINAS O ANÁLOGOS DE LA INSULINA |
| Test de unión a receptores de insulina (IR-A and IR-B) |
| Test de autofosforilación del receptor |
| Test de actividad mitogénica mediada por IGF-1 |
| Medición de la formación de glucógeno |
| Medición de la inducción de lipogénesis |
| Medición de lipolisis inducida |
| Medición de transporte de glucosa transmembrana |
- in vivo: se refiere al procedimiento diagnóstico o experimento que se realiza en el organismo mientras
11
Tabla 4. Ensayos de actividad biológica comúnmente usados para estudios de comparabilidad entre anticuerpos monoclonales anti-TNF
| ANTICUERPOS MONOCLONALES ANTI-TNF |
| Unión in vitro a TNF soluble (sTNF) |
| Unión in vitro a TNF trans-membrana (tm-TNF) |
| Unión a complemento (C1q) |
| Unión in vitro a receptores Fc (RI, RIIa, RIIb, RIIIa V/V, V/F, F/F, RIIIb, FcRn) |
| Ensayos ex vivo de apoptosis |
| Ensayos ex vivo de señalización inversa |
| Ensayos ex vivo de producción de citoquinas |
| Ensayos ex vivo de citotoxicidad dependiente de complemento y de citotoxicidad dependiente de anticuerpo |
Etapa de comparabilidad clínica: se valora la comparabilidad en el comportamiento farmacocinético y farmacodinámico del medicamento de referencia y el medicamento biosimilar en seres humanos. La comparabilidad clínica ha de comenzar, como en el caso de los genéricos, por la comparabilidad farmacocinética. En lo sustancial, los estudios de bioequivalencia con medicamentos biosimilares no difieren de los que estamos acostumbrados a ver para las moléculas de síntesis química. Su objetivo es demostrar que la biodisponibilidad del medicamento biosimilar es igual que la del medicamento de referencia. Le seguiría la comparabilidad farmacodinámica y, cuando no existan modelos farmacodinámicos validados se realizarán estudios de equivalencia terapéutica, según indiquen las recomendaciones reguladoras. Por lo general, se ha de realizar algún estudio de eficacia y seguridad en pacientes que confirme que el comportamiento clínico de ambos medicamentos es similar. Para ello, se elige el diseño de ensayo clínico que tenga la máxima capacidad de encontrar diferencias en el caso de que las hubiera, y que no es necesariamente el mismo diseño que utilizó el original para demostrar la eficacia clínica. Por ejemplo, la Tabla 5 describe variables aceptadas desde el punto de vista regulador para diferentes medicamentos biosimilares.
Tabla 5. Variables aceptadas en Europa para la comparabilidad de la eficacia de medicamentos biosimilares
| MEDICAMENTO | MODELO |
| Insulinas | Área bajo la curva de la glucemia en estudios de clampaje euglucémico-hiperinsulinémico |
| Filgrastim | Medición del área bajo la curva del recuento de neutrófilos |
| Interferón beta | Evolución de lesiones neurológicas por RMN |
| Antineoplásicos | Respuesta tumoral |
| Epoetinas | Niveles de hemoglobina durante la fase de corrección de la anemia en pacientes con insuficiencia renal pre- diálisis (para la vía subcutánea) y en pacientes en diálisis en fase de mantenimiento (para la vía intravenosa) |
| Hormona folículoestimulante | Número de ovocitos recuperables en pacientes sometidas a procedimientos de hiperestimulación ovárica para tratamientos de reproducción asistida |
| Hormona de crecimiento | Velocidad de crecimiento en niños con déficit hormonal |
| OHbejpeatriinvaos ddeebaejostpaesgo umíoalecular | Actividad anti-FXa y anti-FIIa y ratio entre ellas |
La idea que subyace a este desarrollo en etapas, como se ha mencionado con anterioridad, es garantizar que las pequeñas diferencias que puedan encontrarse entre el medicamento de referencia y el biosimilar no tendrán un impacto relevante en el resultado terapéutico final en cada una de las indicaciones para las que ha sido aprobado. Cabe destacar, como se detalla en el siguiente punto, que el ejercicio de comparabilidad se realiza tanto para el desarrollo de medicamentos biosimilares como para medicamentos biológicos de referencia cuando estos sufren modificaciones en sus procesos de producción o desarrollan nuevas formulaciones galénicas (por ejemplo: formulación subcutánea de un medicamento que tenía formulación intravenosa).
13
Cuando un medicamento biológico original cambia su proceso de producción, ¿qué aspectos se comprueban? ¿Qué variabilidad presentan los distintos lotes de un medicamento biológico?
Los medicamentos biológicos, a diferencia de los medicamentos de síntesis química, presentan una variabilidad intrínseca debida a la propia naturaleza de cualquier fuente biológica, así como al proceso de producción, exclusivo de cada fabricante. Por ello, en el caso de los medicamentos biológicos (ya sean originales o biosimilares), se pueden encontrar pequeñas diferencias entre distintos lotes de producción (Figura 1A). Esta variabilidad no requiere revisión de las Agencias reguladoras, siempre que se encuentre dentro de los límites que definen las especificaciones de manufactura.
Es importante señalar que la variabilidad que puede tener el medicamento biosimilar no es mayor que la permitida al correspondiente biológico original entre sus lotes.
Figura 1: Ejemplo de variabilidad entre medicamentos biológicos (adaptado de10 )
|
Existe otra variabilidad en los medicamentos biológicos (ya sean originales o biosimilares) y es la debida a cambios en los procesos de producción (Figura 1B). Con frecuencia los fabricantes de productos biotecnológicos/biológicos realizan cambios en los procesos de producción de sus productos tanto durante el desarrollo como después de la aprobación. Estos cambios en el proceso de producción sí han de ser notificados a las Agencias reguladoras, quienes, en función de la importancia de estos, solicitarán a las compañías la demostración de la comparabilidad del producto antes y después del cambio. Esto es un proceso secuencial, que comienza con estudios de calidad (limitados o completos) y se respalda, según sea necesario, mediante estudios no clínicos, clínicos y de farmacovigilancia, que aseguren que los cambios no afectan a la calidad, la seguridad y la eficacia del producto farmacéutico. En caso contrario, los medicamentos nunca recibirían el aval de las Agencias reguladoras y, por tanto, nunca llegarían al mercado.
Como ejemplo, la Figura 2 recoge los cambios en los procesos de producción que han sufrido algunos medicamentos biológicos originales desde su llegada al mercado.
Figura 2. Cambios en medicamentos biológicos originales durante el proceso de fabricación11
¿Qué es la extrapolación de indicaciones?
La aprobación regulatoria del fármaco biosimilar para el tratamiento de enfermedades que no han sido específicamente estudiadas durante el desarrollo clínico del mismo se denomina extrapolación de indicaciones. Cabe recordar que el objetivo del desarrollo de un medicamento biosimilar no es que este demuestre una relación beneficio/riesgo positiva en cada una de las indicaciones clínicas que están aprobadas para el medicamento original, pues ya lo hizo este en el momento de su aprobación, sino asegurar que ambos medicamentos (original y biosimilar) son lo suficientemente similares como para garantizar que son equivalentes en eficacia y seguridad. Para ello los reguladores revisan una por una cada indicación y las aceptan a la vista de los resultados del ejercicio de comparabilidad y del conocimiento de los mecanismos implicados en el efecto terapéutico en cada una de ellas. Cabe resaltar que el reconocimiento de indicaciones implica que las agencias han evaluado tanto las pequeñas diferencias que pueda haber entre el biosimilar y el producto de referencia como los mecanismos implicados en la eficacia de cada indicación, y han estimado que no se esperan diferencias significativas de eficacia o seguridad entre el biosimilar y el original. Así lo recoge la propia Directriz sobre medicamentos biosimilares de la EMA3: “si la biosimilitud ha sido demostrada en una indicación, la extrapolación a otras indicaciones del producto de referencia puede ser aceptada con una adecuada justificación científica”.
Por otra parte, la extrapolación no es un concepto nuevo ni exclusivo de los medicamentos biosimilares, sino un principio científico bien establecido que se ha utilizado durante muchos años. Por ejemplo, cada vez que un medicamento biológico con varias indicaciones aprobadas sufre cambios importantes en su proceso de fabricación12 formulaciones).
(nuevo sitio de fabricación o desarrollo de nuevas
¿Existe un mayor riesgo de inmunogenicidad asociado al uso de biosimilares?
No, el riesgo de inmunogenicidad en biosimilares no es necesariamente mayor de lo que es en el caso de los medicamentos biológicos originales.
El concepto inmunogenicidad se define, según la EMA, como el potencial o capacidad de una sustancia o antígeno de provocar una reacción o respuesta inmune. Esta propiedad es inherente a todos los medicamentos biológicos, ya sean originales o biosimilares, y puede ser debida no solo a su propia naturaleza sino también a la variabilidad intraindividual de cada paciente.
La propia Agencia requiere que durante el desarrollo de los medicamentos biológicos originales se evalúe su inmunogenicidad, cuestión que se analiza en detalle en guías específicas13,14. Con ello se determina la tendencia de un fármaco a inducir la formación de anticuerpos anti-medicamento, y las posibles consecuencias clínicas derivadas de esta respuesta. Puesto que pequeñas variaciones estructurales pueden modificar el perfil inmunogénico de cualquier producto biológico, estudios de inmunogenicidad comparada son también exigidos a los candidatos a biosimilar.
En cualquier caso, aunque la inmunogenicidad podría ser una cuestión de interés para todos los medicamentos biológicos, hay varias consideraciones importantes a tener en cuenta:
- En la mayor parte de los casos la inmunogenicidad no tiene una traducción clínica relevante en términos de eficacia y
- La naturaleza de las reacciones inmunes depende de muchos factores bien debido al propio paciente (edad, sexo, genética) o inherente al medicamento (dosis, vía de administración, ).
- Todos los medicamentos biológicos tienen un seguimiento después de su comercialización en el marco del Sistema Español de F
¿Cabe esperar mayores reacciones adversas con el medicamento biosimilar que con el medicamento original o de referencia?
No existen evidencias ni fundamentos científicos que sugieran que los medicamentos biosimilares puedan ocasionar más reacciones adversas que sus correspondientes medicamentos de referencia8.
Es importante hacer constar que tras 12 años en el mercado y 700 millones de pacientes tratados no existe en las agencias española ni europea constancia de problemas de seguridad específicos de los biosimilares.
¿Ofrecen los medicamentos biosimilares las mismas garantías sobre calidad, eficacia y seguridad que los medicamentos de referencia?
Como ya se ha adelantado, una vez aprobado, tanto a un medicamento biosimilar como a su medicamento de referencia se les presupone el mismo perfil de calidad, eficacia y seguridad, lo que implica un mismo nivel de reacciones adversas.
Respecto a la monitorización de la seguridad de medicamentos, en 2010 y 2012 la UE adoptó nuevas directivas y regulaciones por las que se modificaban los requisitos en materia de farmacovigilancia, Directiva 2010/84/UE y Directiva 2012/26/UE ya incorporadas en la legislación española por el Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medica- mentos de uso humano. Con esta nueva normativa, surgen nuevos requisitos como: seguimiento adicional, triángulo negro y Plan de Gestión de Riesgos.
El concepto de seguimiento adicional se aplica a “[…] todos los medicamentos que contengan nuevos principios activos, y medicamentos biológicos, incluidos biosimilares.”
Según lo anterior, todo nuevo biosimilar, por tratarse de un medicamento biológico, autorizado después del 1 de enero de 2011 estará sujeto a seguimiento adicional y, por tanto, incluirá el símbolo negro en su prospecto y en el resumen de las características del producto cuando se comercialice en la Ue15.
La evaluación post-comercialización de los biosimilares por tanto es idéntica a la de cualquier otro nuevo medicamento biológico, y tiene como objetivo poder detectar cambios en el balance beneficio/riesgo y controlar la seguridad y la inmunogenicidad de los medicamentos.
Todos los medicamentos biosimilares, por su condición de medicamentos biológicos nuevos que salen al mercado, están obligados a incluir el triángulo negro, indicativo de que son medicamentos sujetos a una especial vigilancia de su seguridad.
Así, un medicamento permanecerá sujeto a seguimiento adicional durante cinco años o hasta que el Pharmacovigilance Risk Assessment Committee (PRAC) decida retirarlo de la lista. (https://www.aemps.gob.es/vigilancia/medicamentosUsoHumano/docs/seguim ientoadicional.pdf).
Otro de los nuevos requisitos que derivaron de esta actualización de la normativa europea en materia de farmacovigilancia fue la inclusión de un Plan de Gestión de Riesgos (PGR) “[...] para cada medicamento para el que se solicite autorización de comercialización a partir de la entrada en vigor del presente real decreto.”, la fecha de entrada en vigor de dicho decreto fue el 27 de julio de 201316 .
El PGR tiene como objetivo determinar el perfil de seguridad del medicamento identificando los riesgos junto a la propuesta de una serie de medidas para que sea posible minimizarlos. Este requisito aplicaría, de nuevo, a cualquier medicamento aprobado después de dicha fecha.
Por último, otro de los requisitos a destacar de los biosimilares para garantizar una correcta monitorización de su seguridad es la trazabilidad tanto de las prescripciones como de las administraciones a los pacientes. Por este motivo los medicamentos biológicos tienen que tener un nombre comercial y ser prescritos por dicho nombre.
Como farmacéutico, ¿cómo puedo contribuir a la eficacia del medicamento y a la seguridad del paciente tratado con medicamentos biosimilares?
El papel del farmacéutico, como profesional sanitario experto en el medicamento, es contribuir a garantizar el uso seguro, efectivo y eficiente de los medicamentos. En el entorno sanitario multidisciplinar, el farmacéutico aporta sus conocimientos y habilidades específicas para mejorar la calidad de vida de los pacientes en relación con la farmacoterapia y sus objetivos terapéuticos.
Mediante el desarrollo de servicios profesionales de adherencia, de seguimiento farmacoterapéutico y de farmacovigilancia, el farmacéutico colabora con el paciente para que utilice el medicamento en los términos establecidos para conse- guir los resultados esperados en la salud del paciente. También coopera con el prescriptor en el seguimiento del tratamiento para asegurar su eficacia y seguridad.
En el tema de la seguridad del paciente en relación con la aparición de reacciones adversas a medicamentos, el farmacéutico actúa en dos frentes fundamentales: farmacovigilancia y trazabilidad17 .
En materia de farmacovigilancia, tanto en el ámbito comunitario como en el hospitalario, el farmacéutico puede contribuir a la seguridad de los pacientes tratados con biosimilares como lo haría con cualquier otro medicamento, es decir, notificando (a través de la llamada tarjeta amarilla) las sospechas de reacciones adversas de medicamentos autorizados. También están incluidas las notificaciones de medicamentos que se empleen en condiciones distintas a las autorizadas18, y las de aquellos no comercializados en España, pero con una autorización de importación. Además, se tendrán que notificar las reacciones adversas graves e inesperadas (aquellas que por su naturaleza, gravedad o consecuencias no son coherentes con la información descrita en la ficha técnica del medicamento)16.
Respecto a la trazabilidad, en el caso de todos los medicamentos, excluyendo los genéricos, deben notificarse por denominación comercial y lote, conforme a lo señalado en el artículo 102 de la Directiva 2001/83/CE19. En el caso de los medicamentos biológicos, ya sean originales o biosimilares, deben prescribirse por marca o nombre comercial (o de “fantasía”) de acuerdo con la Directiva Europea 2012/52/EU20 además del nombre del principio activo (es decir, denominación común internacional, o DCI, que le asigna la OMS). En este sentido, el farmacéutico, como actor clave de la dispensación, juega un papel determinante en asegurar la correcta trazabilidad del medicamento, lo que implica un procedimiento de identificación y además un sistema de gestión de la información para realizar un correcto seguimiento de este. También se ha de contemplar la automatización de los procesos asociados, a través de la tecnología de lectura más idónea para los diferentes agentes de la cadena del medicamento.
Un refuerzo adicional en la trazabilidad y seguridad del uso del medicamento en todos los eslabones de la cadena, desde que es fabricado hasta su dispensación última en las farmacias comunitarias y en los Servicios de Farmacia Hospitalaria, lo supondrá la aplicación del Reglamento Delegado (UE) 2016/161 de la Comisión, de 2 de octubre de 2015, de obligado cumplimiento en los países de la Unión Europea, que incorpora el uso de dispositivos de seguridad en el envase de medicamentos para permitir la verificación de la autenticidad de los medicamentos. La verificación de los dispositivos de seguridad y desactivación del identificador único de los medicamentos será obligatoria en todos los medicamentos sujetos a prescripción médica, salvo en las excepciones previstas, así como en los medicamentos no sujetos a prescripción que se establezcan.
¿Cuál es el ámbito de dispensación de los medicamentos
biosimilares autorizados y comercializados en España?
La mayor parte de los medicamentos biosimilares autorizados y comercializados en España (al igual que sus biológicos de referencia) son utilizados de manera interna en el hospital y dispensados en los Servicios de Farmacia Hospitalaria que establecen las condiciones de utilización más eficiente de estos medicamentos a través de las Comisiones de Farmacia y Terapéutica y su inclusión en las Guías Farmacoterapéuticas. Solo, por el momento, se dispensan en la farmacia comunitaria la insulina glargina, el condroitín sulfato, la folitropina alfa y la enoxaparina sódica.
No obstante, el Consejo General de Colegios Farmacéuticos viene avanzando en sus propuestas al Ministerio de Sanidad, Consumo y Bienestar Social para que esta clase de medicamentos, siempre que sus condiciones de uso lo permitan, puedan ser también dispensados en la farmacia comunitaria facilitando, en su caso, así la accesibilidad de los pacientes a estos fármacos.
En el caso del resto de países de la UE, existen variaciones con respecto a la dispensación de los biosimilares en farmacia comunitaria y farmacia hospitalaria.
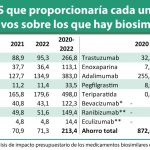
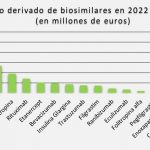
¿Qué vienen a aportar los medicamentos biosimilares?
La aparición de medicamentos biosimilares favorece la competencia en el mercado, lo que se traduce en precios más bajos y, por tanto, en un mejor acceso de los pacientes a tratamientos biológicos (Figura 3). Desde 2006, los medicamentos biosimilares aprobados por la UE han tratado a más de 700 millones de pacientes21 . En definitiva, los medicamentos biosimilares son un aliado indiscutible para favorecer el uso racional de los medicamentos. Asimismo, han traído consigo igualmente una innovación en la gestión de la prestación farmacéutica por cinco vías: i) permiten tratar al mismo número de pacientes con un menor presupuesto; ii) permitirían tratar a un mayor número de pacientes con el mismo presupuesto; iii) liberan recursos que contribuyen a que pueda abordarse también la incorporación de nuevos tratamientos a la práctica clínica; adicionalmente, iv) aumentan la competencia de precios entre compañías; e v) incentivan y aceleran la investigación de las compañías de originales para el desarrollo de nuevas moléculas22.
Figura 3. Eficiencia de la entrada al mercado de biosimilares. Fuente: BioSim
Por otra parte, para su desarrollo, los medicamentos biosimilares se han servido de la experiencia acumulada por los biológicos originales, lo que se ha traducido en procesos de producción muy bien controlados, robustos y reproducibles. En paralelo, la EMA, encargada de la evaluación de los medicamentos biosimilares, ha adaptado sus procesos regulatorios a estos nuevos fármacos ofreciendo las mismas garantías y exigencias que se les aplica a los biológicos de referencia.
Además, algunos de laboratorios que desarrollan medicamentos biosimilares tratan de incorporar valor añadido a sus productos, por ejemplo, a través de la mejora de los dispositivos de administración, lo que se traduce en mayor comodidad para el paciente y, por tanto, en una mayor adherencia al tratamiento, o también a través de sistemas de identificación que agilizan el control de la trazabilidad en los Servicios de Farmacia Hospitalaria y en las farmacias comunitarias.
24
¿Establece la Agencia Europea del Medicamento directrices en cuanto a intercambiabilidad (cambio o sustitución) de medicamentos biológicos, originales o biosimilares?
No. Cuando la EMA lleva a cabo la evaluación científica de un medicamento biosimilar no emite recomendaciones sobre si el biosimilar es intercambiable por su producto de referencia. Tales decisiones se toman a nivel nacional por parte de cada Estado miembro (Figura 4).
Figura 4. Competencias de la EMA y los Estados miembros sobre intercambiabilidad
Como farmacéutico, ¿puedo sustitutir un medicamento de referencia por un biosimilar o un biosimilar por el medicamento de referencia en el acto de la dispensación?
En España, el artículo 89 del capítulo IV, del uso de medicamentos en las oficinas de farmacia, incluido en el Real Decreto Ley 1/2015, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios4, y que regula la sustitución por el farmacéutico establece:
“4. Quedarán exceptuados de esta posibilidad de sustitución aquellos medicamentos que, por razón de sus características de biodisponibilidad y estrecho rango terapéutico, determine el Ministerio de Sanidad y Consumo.”
“5. Cuando la prescripción se realice por denominación comercial, si el medicamento prescrito tiene un precio superior al precio menor de su agrupación homogénea, el farmacéutico sustituirá el medicamento prescrito por el de precio más bajo de su agrupación homogénea. En el caso de los medicamentos biosimilares, se respetarán las normas vigentes según regulación específica en materia de sustitución e intercambiabilidad.”
En España, según la Orden Ministerial SCO/2874/200723 por la que se establecen los medicamentos que constituyen excepción a la posible sustitución, no se permite la sustitución de un medicamento biológico por otro. Es decir, si el médico prescribe un biológico original, el farmacéutico no puede dispensar otro, sea este original o biosimilar. De igual manera, si el medicamento prescrito es un biosimilar, el farmacéutico no puede dispensar ni otro biosimilar, ni el producto original correspondiente.
¿Cuál pretende ser la aportación de BioSim para promover un mejor conocimiento y potenciar una información científica y rigurosa a todos los profesionales sanitarios?
BioSim es la Asociación Española de Biosimilares que representa a empresas que investigan, desarrollan, producen y/o comercializan medicamentos biosimilares, y actualmente está conformada por 15 compañías farmacéuticas.
Entre los principales objetivos de BioSim está lograr una modificación normativa que mejore la incorporación de estos medicamentos al arsenal terapéutico y una labor de formación e información a profesionales sanitarios, así como una mejora en la interlocución con profesionales sanitarios, pacientes, administraciones sanitarias, otras compañías farmacéuticas y otros agentes sanitarios involucrados.
La política de BioSim sobre el uso de biosimilares en España se encuadrará siempre en el respeto a la legislación vigente en cada momento.
Para buscar más información sobre BioSim consulte: web: http://www.biosim.es/
Para buscar noticias e información de interés relacionada con biosimilares consulte: Blog: http://www.biosim.es/blog/
Glosario de términos frecuentemente utilizados al hablar de biosimilares8
Agencia Europea del Medicamento (EMA): agencia descentralizada de la UE, actualmente con sede provisional en Londres y a partir de marzo de 2019 en Amsterdam. Comenzó sus actividades en 1995 y es responsable de la evaluación científica, la supervisión y control de seguridad de los medicamentos desarrollados por empresas farmacéuticas para su uso en la UE. La EMA garantiza que todos los medicamentos disponibles en el mercado de la UE son seguros, eficaces y de alta calidad.
Autorización de comercialización: permiso que concede una autoridad reguladora a una empresa para comercializar un medicamento conforme a las indicaciones descritas en la información del producto, previa presentación por parte de la empresa de la documentación y los datos necesarios de conformidad con el marco regulatorio y legal vigente.
Cambio o Switching: cambio en la prescripción o cuando el médico prescriptor decide cambiar un medicamento por otro con el mismo fin terapéutico.
Extrapolación de indicaciones: decisión de ampliar o no los datos de eficacia y seguridad de una indicación (condición clínica, trastorno o enfermedad) para la que se ha probado un producto biosimilar a otras indicaciones para las que se haya autorizado el producto de referencia.
Farmacovigilancia: procedimientos de controles científicos y de seguridad a los que deben someterse los medicamentos antes, durante y después de su aprobación por parte de las autoridades reguladoras con el objetivo de detectar, evaluar y comprender el beneficio: perfil de riesgo-beneficio de un medicamento. Las actividades de farmacovigilancia cubren todo el ciclo de vida de los medicamentos en términos de seguridad.
Glicosilación: proceso bioquímico por el cual un grupo carbohidratos se une covalentemente a otra molécula, denominada aceptora. En el caso de que la molécula aceptora sea una proteína, la glicosilación puede tener lugar a nivel ribosómico durante el proceso de síntesis proteica o ser añadido a posteriori.
Inmunogenicidad: potencial o capacidad de una sustancia o antígeno de provocar una reacción/respuesta inmune.
Intercambiabilidad: la posibilidad de intercambiar un medicamento por otro que se espera que obtenga el mismo efecto clínico. Este cambio puede realizarse entre un producto de referencia y un biosimilar (o viceversa) o entre dos biosimilares. En función de en quién radique la decisión del cambio, podemos hablar de cambio o switch (prescriptor) o sustitución (farmacéutico).
Medicamento de referencia: medicamento que ha obtenido una autorización de comercialización de un Estado miembro o de la Comisión Europea basándose en los datos clínicos, preclínicos y de seguridad presentados, y al que se refiere la solicitud de autorización de comercialización de un producto genérico o biosimilar.
Medicamento genérico: medicamento desarrollado con el objetivo de ser equivalente a un medicamento ya autorizado (el “medicamento de referencia”). Según la Directiva 2001/83/CE, un “medicamento genérico”: todo medicamento que tenga la misma composición cualitativa y cuantitativa en principios activos y la misma forma farmacéutica, y cuya bioequivalencia con el medicamento de referencia haya sido demostrada por estudios adecuados de biodisponibilidad.
Patente: conjunto de derechos de exclusividad que concede un país (gobierno nacional) a un inventor o a sus cesionarios durante un periodo de tiempo limitado como contrapartida a la difusión pública de su invento. No obstante, por lo general una solicitud de patente debe incluir una o más reivindicaciones que definan el invento, que deberá ser nuevo, no obvio y útil o industrialmente utilizable.
Plan de gestión de riesgos: descripción detallada del sistema de evaluación de riesgos implantado por el fabricante para un determinado medicamento.
Principio activo (o sustancia activa): ingrediente activo o molécula que se incluye en un determinado medicamento y que confiere a este último propiedades para tratar o prevenir una o varias enfermedades específicas.
Sistema de gestión de riesgos: conjunto de iniciativas e intervenciones en materia de farmacovigilancia que están concebidas para identificar, caracterizar, prevenir o minimizar los riesgos relativos a un medicamento, incluida la evaluación de su beneficio: perfil de riesgos/beneficios.
Sustitución: práctica de dispensar un medicamento en lugar de otro equivalente e intercambiable a nivel de farmacia sin consultar al responsable de su prescripción.
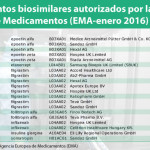
Anexo 1. Medicamentos biosimilares autorizados por la CE
Nombre comercial Principio Activo
Empresa Autorizada para la comercialización
Fecha de Autorización
Omnitrope somatropin Sandoz GmbH 12/04/2006 Abseamed epoetin alfa Medice Arzneimittel Pütter GmbH & Co. KG 28/08/2007 Binocrit epoetin alfa Sandoz GmbH 28/08/2007
Epoetin Alfa Hexal epoetin alfa Hexal AG 28/08/2007 Retacrit epoetin zeta Hospira UK Limited 18/12/2007 Silapo epoetin zeta Stada Arzneimittel AG 18/12/2007 Ratiograstim filgrastim Ratiopharm GmbH 15/09/2008 Tevagrastim filgrastim Teva GmbH 15/09/2008
Filgrastim Hexal filgrastim Hexal AG 06/02/2009
Zarzio filgrastim Sandoz GmbH 06/02/2009 Nivestim filgrastim Pfizer Europe MA EEIG 08/06/2010 Inflectra infliximab Pfizer Europe MA EEIG 10/09/2013 Remsima infliximab Celltrion Healthcare Hungary Kft. 10/09/2013 Ovaleap follitropin alfa Teva Pharma B.V. 27/09/2013 Grastofil filgrastim Apotex Europe BV 18/10/2013 Bemfola follitropin alfa Gedeon Richter Plc. 27/03/2014 Abasaglar insulin glargine Eli Lilly Nederland B.V. 09/09/2014 Accofil filgrastim Accord Healthcare Ltd 18/09/2014 Benepali etanercept Samsung Bioepis UK Limited 14/01/2016
Flixabi infliximab Samsung Bioepis UK Limited (SBUK) 26/05/2016 Inhixa enoxaparin sodium Techdow Europe AB 15/09/2016 Thorinane enoxaparin sodium Pharmathen S.A. 15/09/2016 Terrosa teriparatide Gedeon Richter Plc. 04/01/2017 Movymia teriparatide STADA Arzneimittel AG 11/01/2017 Truxima rituximab Celltrion Healthcare Hungary Kft. 17/02/2017 Amgevita adalimumab Amgen Europe B.V. 22/03/2017 Solymbic adalimumab Amgen Europe B.V. 22/03/2017 Rixathon rituximab Sandoz GmbH 15/06/2017
Riximyo rituximab Sandoz GmbH 15/06/2017
Erelzi etanercept Sandoz GmbH 23/06/2017 Blitzima rituximab Celltrion Healthcare Hungary Kft. 13/07/2017 Ritemvia rituximab Celltrion Healthcare Hungary Kft. 13/07/2017 Rituzena (prev. Tuxella ) rituximab Celltrion Healthcare Hungary Kft. 13/07/2017 Insulin lispro Sanofi insulin lispro sanofi-aventis groupe 19/07/2017 Imraldi adalimumab Samsung Bioepis UK Limited (SBUK) 24/08/2017
Cyltezo adalimumab Boehringer Ingelheim International GmbH 10/11/2017 Ontruzant trastuzumab Samsung Bioepis UK Limited (SBUK) 15/11/2017 Mvasi bevacizumab Amgen Europe B.V. 15/01/2018 Herzuma trastuzumab Celltrion Healthcare Hungary Kft. 09/02/2018 Semglee insulin glargine Mylan S.A.S 23/03/2018 Kanjinti trastuzumab Amgen Europe B.V., Breda 16/05/2018 Zessly infliximab Sandoz GmbH 18/05/2018
30
31
Anexo 2. Medicamentos biosimilares autorizados por la AEMPS
| Nombre comercial Principio ActivoOmnitrope somatropina Retacrit epoetina zseta Ratiograstim filgrastim Binocrit epoetina alfa Zarzio filgrastim Tevagrastim filgrastim Nivestim filgrastim Inflectra infliximab Remsima infliximab Bemfola folitropina alfa Accofil filgrastim Ovaleap folitropina alfa Condroitin sulfato condroitina sulfato sodi Condroitina sulfato condroitina sulfato sodi Abasaglar insulina glargina Flixabi infliximab Cerise condroitina sulfato sodi | Empresa Autorizada para la comercialización | Fecha de Autorización | |
| Sandoz Gmbh | 06/07/2006 | ||
| Hospira Uk Limited | 21/07/2007 | ||
| Ratiopharm Gmbh | 18/02/2008 | ||
| Sandoz Gmbh | 25/09/2008 | ||
| Sandoz Gmbh | 31/03/2009 | ||
| Teva Gmbh | 07/12/2009 | ||
| Pfizer Europe Ma Eeig | 19/10/2010 | ||
| Pfizer Europe Ma Eeig | 25/03/2014 | ||
| Celltrion Healthcare Hungary Kft. | 23/06/2014 | ||
| Gedeon Richter Plc. | 23/06/2014 | ||
| Accord Healthcare Limited | 10/10/2014 | ||
| Teva B.V. | 16/02/2015 | ||
| o Kern Pharma, S.L. | 26/10/2015 | ||
| o Abamed Pharma, S.L. | 13/11/2015 | ||
| Eli Lilly Nederland B.V. | 25/02/2016 | ||
| Samsung Bioepis Uk Limited | 23/06/2016 | ||
| o Abamed Pharma, S.L. | 07/07/2016 | ||
| Benepali | etanercept | Samsung Bioepis Uk Limited | 14/03/2017 |
| Erelzi | etanercept | Sandoz Gmbh | 07/04/2017 |
| Riximyo | rituximab | Sandoz Gmbh | 26/07/2017 |
| Rixathon | rituximab | Sandoz Gmbh | 26/07/2017 |
| Truxima | rituximab | Celltrion Healthcare Hungary Kft. | 31/07/2017 |
| Crusia | enoxaparina sódica | Laboratorios Farmaceuticos Rovi, S.A. | 20/02/2018 |
| Enoxaparina Rovi | enoxaparina sódica | Laboratorios Farmaceuticos Rovi, S.A. | 27/02/2018 |
| Herzuma | trastuzumab | Celltrion Healthcare Hungary Kft. | 16/03/2018 |
| Inhixa | enoxaparina sódica | Techdow Europe Ab | 16/03/2018 |
| Amgevita | adalimumab | Amgen Europe B.V | 13/04/2018 |
| Ontruzant | trastuzumab | Samsung Bioepis Uk Limited | 13/04/2018 |
| Imraldi | adalimumab | Samsung Bioepis Uk Limited | 25/05/2018 |
| Kanjinti | trastuxumab | Amgen Europe B.V | 28/05/2018 |
| Zessly | infliximab | Sandoz Gmbh | 16/07/2018 |
| Movymia | teriparatida | Stada Arzneimittel Ag | 01/08/2018 |
| Hyrimoz | adalimumab | Sandoz Gmbh | 16/08/2018 |
| Hepaxane | enoxaparina sódica | Chemi S.P.A. | 27/09/2018 |
| Pelgraz | pegfilgrastim | Accord Healthcare Limited | 31/10/2018 |
| Hulio | adalimumab | Mylan S.A.S | 15/11/2018 |
| Trazimera | trastuzumab | Pfizer Europe MA EEIG | 30/11/2018 |
| Pelmeg | pegfilgrastim | Cinfa Biotech S.L | 12/12/2018 |
32
Bibliografía
- European Medicines Questions and answers on biosimilar medicines (similar biological medicinal products). EMA/837805/2011, Updated 27 September 2012
- http://www.fgov/AboutFDA/CentersOffices/OfficeofMedicalProductsand Tobacco/CBER/ucm133077.htm European Medicines Agency. Questions and answers on biosimilar medicines (similar biological medicinal products). EMA/837805/2011, Updated 27 September 2012
- European Medicines Agency: Guideline on similar biological medicinal EMEA/CHMP/437/04 Rev. 1
- Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios
- https://www.ema.eureu/en/medicines/field_ema_web_categories%253 Aname_field/Human/ema_group_types/ema_medicine?search_api_views_fulltex t=BIOSIMILAR
- European Medicines Agency: Similar biological medicinal products containing biotechnology-derived proteins as active substance: quality EMEA/CHMP/BWP/247713/2012
- European Medicines Agency: Similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical EMEA/CHMP/BMWP/42832/2005 Rev. 1
33
- Estudio informativo de consenso Lo que debe saber sobre los medicamentos biosimilares. Proceso sobre Responsabilidad Corporativa en el ámbito de las farmacéuticas. Acceso a los medicamentos en Europa. Comisión Europea
- https://www.aemps.gob.es/laAEMPS/eventos/medicamentos-uso- humano/2017/docs/J-biosimilares-extrapolacion/2_Truxima-primer-Biosimilar- Rituximab-MabThera-Rituxan-D.Perpdf
- https://www.ema.eureu/documents/leaflet/biosimilars-eu-information- guide-healthcare-professionals_en.pdf
- Degree of prescriber's knowledge about variability in biological drugs "innovators" in manufacturing Jiménez-Pichardo L, Gázquez-Pérez R and Sierra-Sánchez JF (2017). Eur J Clin Pharmacol
- https://www.ema.eureu/documents/scientific-guideline/guideline- similar-biological-medicinal-products-containing-biotechnology-derived- proteins-active_en-0.pdf
- European Medicines Agency: Immunogenicity assessment of biotechnology- derived therapeutic (Currently under revisión). EMEA/CHMP/BMWP/14327/2006
- European Medicines Agency: Immunogenicity assessment of monoclonal antibodies intended for in vivo clinical EMA/CHMP/BMWP/86289/2010
- https://www.aemps.gob.es/vigilancia/medicamentosUsoHumano/ htm#significado
34
- Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso
- http://www.portalfarma.com/Profesionales/campanaspf/categorias/ Documents/Documentos- Publica/2010_Informe_Tpdf
- Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales
- Directiva 2001/83/CE del Parlamento Europeo y del Consejo de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos para uso humano
- Directiva de ejecución 2012/52/UE de la Comisión, de 20 de diciembre de 2012, por la que se establecen medidas para facilitar el reconocimiento de las recetas médicas expedidas en otro Estado miembro
%20Biosimilar%20Medicines%20Group,%20EU%20experience-AVH- US%20FDA%20Adcom.pdf
- Orden SCO/2874/2007, de 28 de septiembre, por la que se establecen los medicamentos que constituyen excepción a la posible sustitución por el farmacéutico con arreglo al artículo 4 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios
35
|
BioSim - Asociación Española de Biosimilares
Calle Condesa de Venadito, 1 28027 - Madrid
Teléfono: +34 91 864 31 32 www.biosim.es | info@biosim.es




















 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: