“Tenemos que pasar de comprar por precio a comprar por valor añadido. Si se compra solo por precio nos quedaremos sin desarrollos futuros de biosimilares”. Son palabras del presidente de la Asociación Española de Biosimilares (Biosim), Joaquín Rodrigo, durante el acto de presentación de la Memoria Bienal de Actividades de la asociación.
Para Rodrigo, esta manera de “sacar el máximo provecho” a la Ley de Contratos del Sector Público, es uno de los retos que tiene Biosim para los próximos tiempos junto a conseguir un “diferencial de precios respecto del medicamento original”. En este sentido, según el presidente de la asociación, “si tienes un producto que aumenta la competencia en el mercado y sacas uno igual o hay diferencia de precio o es difícil que se consiga volumen”.
Rodrigo participó en un diálogo junto a la directora general de la patronal, Regina Múzquiz, en el que, a preguntas de Fernando Mugarza, director y cofundador de Grupo de Soluciones de Comunicación y Reputación (SC&R), fueron abordando diferentes aspectos de los primeros dos años y medio de historia de Biosim.
Biosim: una asociación integradora
Ambos responsables de la asociación consideraron que el éxito de la misma, única y pionera en Europa, fue posible por la “generosidad de muchos”. Según explicaron, tanto Farmaindustria como Aeseg tenían sus propios grupos de biosimilares y sus miembros dieron el paso de crear un “proyecto integrador”.
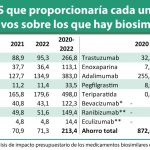
Con respecto a la evolución del mercado de los biosimilares, Múzquiz explicó que “progresa adecuadamente, pero puede mejorar claramente”. A pesar de esta visión, la directora general de la patronal se queja de la falta de información transparente que existe ya que no es posible conocer datos económicos de lo que supone la incorporación de biosimilares en el Sistema Nacional de Salud. “La información que tenemos es sobre número de envases, no hay datos económicos” oficiales, aunque anunció que están trabajando con economistas para disponer de su propio informe. “En cualquier caso, estamos por debajo de la media europea aunque hay mucha variabilidad según de qué moléculas se hable”, aseguró.
Como hitos de lo conseguido por Biosim en estos últimos años, su presidente destacó la formación “independiente y veraz sobre lo que es un biosimilar”. Según él, había “desinformación” y fue en eso en lo que se centraron en los primeros tiempos. Para atajar esta situación, Rodrigo explicó que se ha trabajado estrechamente con la Organización Médica Colegial así como con pacientes y farmacéuticos dando lugar a tres guías específicas para cada uno de estos colectivos.
Plan de genéricos y biosimilares
Con respecto al Plan de Genéricos y Biosimilares Múzquiz aseguró que su mera existencia “hay que valorarla positivamente”. Además, para ella es una “buena noticia” que la Comisión Permanente de Farmacia del Consejo Interterritorial (CISNS) haya llegado a un consenso sobre estos medicamentos.
Entrando a valorar algunas cuestiones concretas, Múzquiz indicó que están de acuerdo con algunas medidas, como la formación o los plazos burocráticos, pero les parecen “inaceptables” otras como los conjuntos del Sistema de Precios de Referencia por ATC-4. Para ella son “medidas de ahorro cortoplacistas”.
Además, consideró que hay otras medidas clave que no se han incorporado. Entre ellas sería la incentivación a los centros y servicios que permitan mayores ahorros por la utilización de biosimilares y, por otro lado, que siempre se utilice la fórmula del acuerdo marco en los servicios de salud, con el objetivo de “evitar las tentaciones de los hospitales de abaratar como sea las facturas”.
Visión internacional
Tras el diálogo entre ambos dirigentes, el farmacólogo e investigador del Departamento de Farmacología, Terapéutica y Toxicología de la Universidad Autónoma de Barcelona, Fernando de Mora realizó una ponencia en la que se analizaba el recorrido internacional de los biosimilares. Unos productos que para este experto “son ciencia pura y dura, y su regulación también”.
Mora puso en valor el sistema de regulación existente en Europa, que se ha exportado a países como Estados Unidos, Canadá, Australia o Japón, entre otros, y lo contrapuso con sistemas de regulación de otras zonas geográficas que no ofrecen tantas garantías.

Este experto aseguró que hay medicamentos aprobados en países de América Latina que “más que biosimilares son biocuestionables puesto que su biosimilaridad es cuestionable”. Según él, se trata de medicamentos que “jamás se lanzarían en Europa”.
A este respecto puso el ejemplo de un rituximab retirado recientemente en México y que de haberse seguido las reglas vigentes en la Unión Europea “nunca habría llegado al mercado”. A este respecto, Mora aseguró que en algunos de estos países se hace la vista gorda para incrementar el acceso a medicamentos o facilitar la producción por parte de compañías locales a cambio de reducir la seguridad.
Suspicacias sobre los biosimilares
Mora también afrontó las reservas que en algunos ámbitos se tiene sobre estos productos y, a este respecto, consideró que parte del problema viene de que se trata de productos “que no son idénticos”. A este respecto, recordó que “no hay nada idéntico en biología, como mucho equivalente o no significativamente distinto”.
El experto reconoció, por tanto, que “no hay igualdad matemática” entre biosimilar y original, pero igual que tampoco la hay “entre dos lotes de un original”
Además, consideró que la terminología utilizada ‘similar’ no ha ayudado ya que se puede poner el énfasis en lo que no se es (diferencias) en vez de en los que sí (igualdades).























 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: