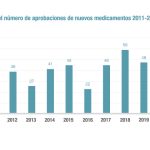
La Agencia Europea de Medicamentos (EMA) ha hecho público un balance de actividad correspondiente a 2019, donde puede verse la emisión de 66 recomendaciones de autorización (frente a cuatro opiniones negativas), de las que 30 estuvieron relacionadas con nuevas sustancias activas. Una de ellas fue una terapia avanzada, siete recibieron la designación huérfana y cinco eran biosimilares.
Además, se revocaron 12 autorizaciones de comercialización, tres fármacos entraron en el esquema Prime para garantizar el acceso temprano, otros tres fueron sometidos a una evaluación acelerada (entre ellos, una nueva vacuna contra el ébola, Ervebo, para adultos), a ocho se les concedió una autorización condicional, también para agilizar su acceso, y uno fue admitido bajo circunstancias especiales. En estos dos últimos casos, las opiniones positivas conllevan la obligación de los titulares de completar los datos presentados y confirmar la eficacia, seguridad y/o efectividad de estas nuevas opciones terapéuticas.
De los nuevos medicamentos recomendados para aprobación, cabe destacar que siete pertenecían al área de Hematología, cinco a la de Oncología, y detrás quedan, por volumen de opiniones positivas, los dirigidos a enfermedades infecciosas (3) y para del sistema endocrino (3).
Junto a estas actuaciones, la Agencia hace referencia a las realizadas una vez que los fármacos son comercializados, momento en el que continúa la monitorización para garantizar que el balance riesgo-beneficio positivo se mantiene en vida real. Si esto no es así, la EMA puede instar a una rectificación de la información, una suspensión de comercialización y, en última instancia, a una retirada del mercado de un producto o de varios lotes del mismo.
Ejemplos de ello han sido la recomendación de nuevas medidas para evitar efectos fatales por el uso de metotrexato en enfermedades reumatológicas; la llamada a la revocación de la autorización a antitusivos con fenspiride por su posible impacto en el ritmo cardiaco; o a la restricción del uso de Lemtrada en esclerosis múltiple por efectos adversos graves, incluidas muertes; la obligación de aplicar medidas para minimizar el riesgo de que se formen coágulos como consecuencia del uso de Xeljanz en enfermedades inflamatorias; la recomendación de restringir el uso de Gilenya para tratar la esclerosis múltiple en embarazadas y mujeres en edad fértil por posibles daños al feto; la alerta sobre las posibles consecuencias del uso de los nuevos anticoagulantes orales (Eliquis, Pradaxa, Lixiana, Roteas y Xarelto) en pacientes con historial de trombosis que han sido diagnosticados de síndrome antifosfolípido, así como la indicación de no prescribir Xarelto para prevenir trombosis en pacientes que se hayan sometido recientemente a reemplazo de válvula aórtica mediante transcatéter.























 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: