La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha comunicado este martes 5 de mayo que los estudios observacionales de seguimiento prospectivo sin ánimo comercial sobre medicamentos utilizados para Covid-19, en los que el promotor sea un investigador de una organización independiente (grupos de investigación, sociedades científicas), serán considerados de interés sanitario y clasificados como EPA-AS. Eso implica que se les dará la misma consideración que a los promovidos por Autoridades Sanitarias o financiados con fondos públicos.
De cara a su evaluación y autorización, la Aemps se compromete, además de a ofrecerles apoyo metodológico, a solicitar únicamente, además del protocolo, el dictamen favorable del CEIm. La resolución de autorización se emitirá en un plazo máximo de siete días naturales desde la recepción del dictamen del CEIm.
Adicionalmente, "con el fin de contribuir a mejorar la calidad y la eficiencia de la investigación de tipo observacional sobre Covid-19", la Agencia anuncia su intención de "facilitar la colaboración entre investigadores de distintos centros que proponen estudios con objetivos comunes". De hecho, aseguran que ya están poniendo en contacto a investigadores, "por si fuera factible que entre ellos se materialice algún tipo de colaboración y en su caso la realización de estudios multicéntricos".
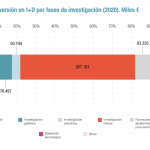
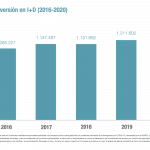
Ese mismo espíritu colaborativo es el que pretenden impulsar con los ensayos clínicos. Consideran que "es importante sumar esfuerzos en torno a grandes ensayos clínicos con poder estadístico para completar el reclutamiento y obtener resultados que ayuden a la toma de decisiones cínicas y a las necesarias para estar preparados frente a un potencial aumento de casos".
En este sentido, llaman a los investigadores a "valorar el interés de sumarse a ensayos clínicos que ya estén en marcha (consultar el Registro Español de estudios clínicos (REec) https://reec.aemps.es/reec/public/web.html) antes de plantearse poner en marcha nuevos ensayos".
También hay una alusión a los ensayos clínicos de promotor sin ánimo comercial, a los cuales se les exime de la tasa. Además, los contratos que habitualmente se tienen que firmar con los centros podrá sustituirse, de forma excepcional, "por un documento de conformidad de la dirección del centro".






















 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: