El Grupo de enfermedades raras y medicamentos huérfanos de la Sociedad Española de Farmacia Hospitalaria (Orphar-SEFH), ha realizado su primer Informe Horizon Scanning de Medicamentos Huérfanos en el que identifica los nuevos medicamentos huérfanos no oncológicos, así como sus nuevas indicaciones, que han entrado ya en la fase regulatoria en Europa.
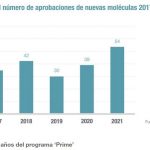
Concretamente, la clasificación que se ha seguido se compone de cuatro categorías: los incluidos en el programa Prime, que proporciona un apoyo temprano y proactivo al promotor para la generación de datos sólidos y permitir una evaluación acelerada; los que están en proceso de evaluación por el Comité de Medicamentos de Uso Humano (CHMP); los que cuentan ya con la opinión positiva del CHMP y están pendientes de la decisión de la CE, y los que se encuentran autorizados por la CE pero no están comercializados todavía en España.
De la primera categoría han identificado un total de 26 innovaciones, de las cuales, 14 son terapias avanzadas, nueve son sustancias químicas y tres productos biológicos. Las áreas terapéuticas más destacadas son la Hematología y la Hemostasia.
De la segunda han hallado 21, con cuatro terapias avanzadas, 11 químicos y 6 biológicos, siendo la Neurología, las Enfermedades Infecciosas y la Hematología y Hemostasia las áreas preferentes.
Finalmente, de la tercera han identificado tres (dos nuevos medicamentos y una nueva indicación, todos ellos químicos), y de la última, 22, entre las que hay 18, con dos terapias avanzadas, ocho químicos y ocho biológicos entre los autorizados por primera vez, y cuatro nuevas tres químicos y un biológico entre las nuevas indicaciones.
Tras la presentación de los resultados, José Luis Poveda, coordinador de Orphar-SEFH, ha especificado que la vocación del informe es "dinámica" y se plantean que pueda ser actualizado "con una periodicidad semestral, tanto para reflejar los cambios experimentados por los medicamentos presentes en cada categoría, como para incluir los nuevos medicamentos que inicien su evaluación por la EMA".
La información se dirige, ha explicado, a decisores y profesionales sanitarios del SNS, a los que podría ser de utilidad "para anticiparse con tiempo suficiente a la innovación terapéutica en el campo de las enfermedades raras que podría ser introducida en España en un futuro próximo", ha continuado.
Por su parte, la presidenta de la SEFH, Olga Delgado, ha destacado que, aunque "la nueva era de innovación terapéutica en enfermedades raras es una gran oportunidad para el cuidado de la salud de los pacientes", plantea también algunos "desafíos para la sostenibilidad de los sistemas de salud". Por eso, considera útil disponer de "una mirada más allá de los plazos habituales para poder hacer un adecuado análisis, evaluación y posicionamiento de las innovaciones terapéuticas que además permitan implementar nuevos enfoques de pago por resultados de estas tecnologías disruptivas de manera temprana".

























 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: