La consultora IQVIA ha convocado recientemente un encuentro virtual para presentar los resultados de un estudio sobre la optimización de los biosimilares en beneficio de la sostenibilidad del sistema. En el encuentro se ha hecho hincapié en la necesidad de tener el sistema “engrasado” para incorporar esos biosimilares con agilidad y permitir a pacientes y organizaciones extraer lo mejor de estas terapias.
Murray Aitken, autor del informe y director ejecutivo del Instituto de Ciencia de Datos Humanos de IQVIA, ha recordado en la reunión que la pandemia ha sido “por decirlo con suavidad” un reto para acceder a medicamentos para el cáncer y muchas otras enfermedades. Aitken considera que estamos en un momento clave para aprovechar la valiosa contribución de los biosimilares como instrumentos de acceso a los medicamentos en un momento en el cual, además, la presión presupuestaria es aún mayor.
También suya ha sido la advertencia sobre la avalancha de patentes vencidas en los próximos años (2024-2029). “Las compañías toman sus decisiones sobre inversión en nuevas moléculas ahora, por eso es este el momento para hablar de sostenibilidad”, ha apuntado.
En opinión de Isabel del Río, subdirectora de la Asociación Española de Biosimilares (Biosim), estamos “sobradamente preparados” para gestionar esos nuevos lanzamientos y su incorporación. Entre otros factores, porque ya contamos con una experiencia de 15 años con medicamentos biosimilares. “Sin embargo -matiza- eso no significa que no tengamos que seguir adelantándonos, por ejemplo con acciones formativas que se pongan en marcha antes de que un biosimilar esté disponible”.
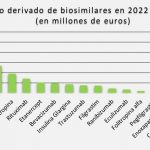
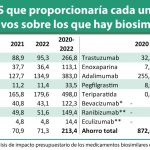
Por ese motivo, ha recordado en una conversación al hilo del nuevo trabajo ahora presentado por IQVIA el estudio de impacto presupuestario de los biosimilares en el SNS dirigido por el profesor Manuel García Goñi (UCM). De acuerdo con sus datos, el ahorro prospectivo que se espera de la entrada de nuevos biosimilares de bevacizumab, ranibizumab y eculizumab entre 2020 y 2022 alcanzará los 114 millones de euros. Si su lanzamiento al mercado se retrasara 9 meses respecto a las fechas de comercialización previstas se reduciría este ahorro en 9.7 millones de euros.
Asimismo, ante un análisis (el de IQVIA) que considera particularmente interesante, ha lamentado que en España sea tan difícil obtener datos sobre empleo de biosimilares. “Es la evidencia que nos permitiría ganar en eficacia en las intervenciones orientadas a optimizar su empleo”, ha razonado.
Visión de los Pacientes
Para los pacientes, en boca de Luisa Avedano, máxima responsable de la Federación Europea de Asociaciones de Enfermedad de Crohn y Colitis Ulcerosa (EFCCA), resulta “particularmente confuso y frustrante” el retraso entre la aprobación de medicamentos biosimilares por parte de las autoridades europeas y el acceso en el propio país “o incluso en un hospital concreto”. Avendano cree que un proceso más transparente sería de gran ayuda.
Por su parte, Dorthe Bartels, de la organización farmacéutica Amgros, ha compartido su experiencia en Dinamarca haciendo hincapié en la agilidad: “Incorporar biosimilares con rapidez significa que ahorras más que si lo haces con lentitud, eso está claro, y estás ganando dinero para terapias nuevas, para más pacientes, para medicamentos innovadores…”
La visión de la industria fue aportada por Ian Henshaw, director del área de biosimilares de Biogen, quien considera que estos medicamentos van ganando terreno en Europa, aunque su avance es desigual. Con la mirada en el futuro, él también piensa que se puede hacer mucho más. “Con una estrategia de horizon scanning, cuanto más te organizas, más podrás hacer, incluyendo mejorar el acceso de los pacientes a los tratamientos”, ha apuntado.
La moderadora, Sue Saville, ha preguntado si sería una opción reducir la cantidad de evidencia requerida actualmente para la aprobación de biosimilares. Rene Anour, de la agencia austriaca del medicamento (AGES) ha intervenido para indicar que ese es el camino de la Agencia Europea del Medicamento (EMA), que permite presentar datos preliminares para valorar si en fases más avanzadas de la aprobación será posible reducir el volumen de información requerida.
Según Anour, un reto en este terreno es la definición de variables que sean indicadores fiables de cuándo una diferencia en la molécula puede traducirse en diferencias clínicas. Asimismo, ha valorado que la posibilidad es más real con medicamentos sencillos que con terapias complejas, como los anticuerpos monoclonales.
Anour ha animado a las compañías a presentar propuestas elaboradas con unos estándares de tal calidad que permitan, con seguridad, rebajar la exigencia de datos con posterioridad.
Los criterios de un mercado sostenible

A partir de su colaboración con autoridades de cinco países (España, Austria, Francia, Polonia e Italia) para la elaboración del estudio, Aitken y sus colaboradores definieron criterios para poder hablar de mercados sostenibles: acceso mejorado a terapias biológicas desde el lanzamiento de un biosimilar, regulación que hace ágil el acceso, disponibilidad de guías terapéuticas, políticas de sustitución que eviten el cambio sin supervisión médica, grado elevado de competencia (con múltiples desarrolladores), precios basados en esa competencia y modelos de compra que impulsen competencia y penetración en el mercado.
Una observación común a los países estudiados es que “no hemos visto una mejora en el acceso a terapias biológicas, o al menos no el que cabría esperar si hubiera más compañías compitiendo en el mercado”.
Por eso, considera que tanto la puesta en marcha de políticas de apoyo para el empleo de biosimilares como las de educación de profesionales y pacientes son dos aspectos importantes en los que será necesario trabajar aún más.
El precio como ventaja, y como problema
También ha advertido que diversas políticas de adquisición en marcha prestan atención al precio como criterio único, lo cual ha señalado como un error fundamental. También al respecto ha matizado que existen diferencias no solo nacionales, sino también regionales e incluso locales.
Tanto durante su intervención como al hablar el resto de ponentes (representantes de agencias reguladoras, pacientes y clínicos) este ha sido un tema recurrente.
Se ha planteado que la espiral descendente de precios reduce el número de ‘jugadores’, deteriora la competencia y puede acabar siendo contraproducente porque un único proveedor puede elevar el precio, pero también puede encontrar dificultades de suministro.
El tema de la necesidad de una mayor formación y campañas informativas sobre biosimilares ha surgido de nuevo al plantearse que, para algunas personas, los biosimilares son “versiones más baratas” de los medicamentos disponibles, y no en el mejor sentido de la palabra.
Bartels ha razonado que las campañas deben tener como principal objetivo los profesionales sanitarios. Según ella, si un profesional está convencido, esa confianza se transmite a los pacientes, y es de hecho una parte importantísima de su labor.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: