La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha publicado su 'Memoria de Actividades 2018', en la que hace un desglose de las actuaciones llevadas a cabo durante el pasado año, para las que hizo uso de un presupuesto de 46,8 millones y para las que se apoyó en una plantilla de 526 empleados.
El documento arranca con sendos artículos del presidente de la Agencia, cargo que recae en el secretario general de Sanidad, Faustino Blanco, y la directora, María Jesús Lamas. El primero destaca entre los principales hitos los esfuerzos realizados para luchar contra las resistencias a los antibióticos, que se han materializado en un nuevo Plan Nacional 2019-2021, el proceso de regularización de los productos homeopáticos o los avances regulatorios en cosmetovigilancia, entre otros. Lamas, por su parte, hace hincapié en el trabajo coordinado con la Agencia Europea de Medicamentos (EMA) y la Red de Jefes de Agencias Nacionales, por ejemplo, para mitigar los problemas de suministro, y las acciones llevadas a cabo por la Aemps en este ámbito.
Pero, como ya es sabido, la actividad ordinaria de la Aemps está apegada también a otras cuestiones más ordinarias, como es la autorización de medicamentos, la vigilancia de su seguridad, o la supervisión de la investigación clínica. En el primero de estos apartados, la Agencia informa de la recepción de 2.116 solicitudes de autorización, incluyendo todos los procedimientos posibles (nacional, descentralizado, reconocimiento mutuo o centralizado), que se saldaron con 1.338 respuestas positivas, 189 denegaciones y 589 desistimientos por parte de los solicitantes.
Al finalizar el año, había en España un total de 18.072 medicamentos autorizados, de los que se derivaban más de 31.000 presentaciones. Destaca la Aemps, en este apartado, el elevado número de revocaciones de autorización, causadas, principalmente, de la falta de comercialización efectiva tras tres años de la obtención de la autorización, o por motivos comerciales. Excepcionalmente, añaden, las autorizaciones se retiran también por falta de seguridad y/o eficacia.
Señalan además que, de los medicamentos autorizados, el 71,41% estaba sujeto a receta, el 14,35% estaba calificado como de uso hospitalario, el 7,07% como diagnóstico hospitalario y el 7,15% restante no requería prescripción.
Otra información de interés que puede encontrarse en la memoria de actividades tiene que ver con los informes de posicionamiento terapéutico (IPT). En 2018 se iniciaron un total de 82, se finalizó la fase I antes de la decisión de precio en 52, y 32 se publicaron después de dicha decisión. El 55% de los IPT publicados estaban vinculados a antineoplásicos e inmunomoduladores, el 17% a fármacos para el tracto alimentario y el metabolismo, mientras que los derivados sanguíneos y órganos hematopoyéticos aglutinaron el 7%, igual que los antiinfecciosos y los dirigidos al sistema respiratorio.
Además, la Aemps es la responsable de actuar también ante la solicitudes de medicamentos no autorizados en España. En total, recibió 31.719 solicitudes individuales, de las que autorizó 31.316. Además, recibió 33.678 peticiones de uso compasivo, de las que aprobó 33.211. El resto estaban denegadas o pendientes de respuesta al cierre del informe.
Actuaciones relacionadas con la seguridad
En lo que respecta a las actuaciones relacionadas con la seguridad de los medicamentos, la Aemps informa de 41.959 notificaciones recibidas por el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), una cifra que casi se ha duplicado con respecto a años anteriores, aunque dicho aumento se explica, según la Agencia, con el hecho de que las compañías hayan comenzado a enviar información sobre sospechas de reacciones adversas, aunque no se consideren graves, yendo un paso más allá de lo que se hacía hasta finales de 2017.
En lo que respecta a la evaluación de la seguridad, el organismo dependiente del Ministerio de Sanidad trabaja en coordinación con la red de agencias europeas, contribuyendo además a la generación de informes, definición de los planes de gestión de riesgos para cada medicamento, los estudios observacionales o los arbitrajes de seguridad. Muestra del peso en Europa es el hecho de que España haya coordinado la evaluación de seguridad en la UE, que ascendió a 533, una cifra que ha ido en aumento en los últimos años.
Esta actividad evaluadora se ha saldado con modificaciones relacionadas con la seguridad de 4.639 medicamentos en 2018, la publicación de 15 notas informativas y un buen número de cartas a laboratorios, cuyo contenido están obligados a difundir.
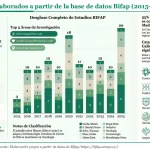
La Agencia también destaca la labor realizada en el marco del programa Bifap, siglas que corresponden a la Base de Datos para la Investigación Farmacoepidemiológica en Atención Primaria, en el que participan nueve comunidades autónomas y colaboran 1.495 médicos. Sus datos, explican, "son utilizados regularmente por EMA para sustentar las decisiones del PRAC y son fundamentales para todas las actuaciones en farmacovigilancia a nivel nacional, como la gestión de los riesgos a los datos de utilización por segmentos de edad que se utilizan para gestionar la comunicación en las notas informativas".
Evaluación de la investigación
Finalmente, cabe resaltar la actividad de la Agencia en materia de investigación clínica. En total, se autorizaron 800 ensayos en 2018, se denegaron 19 y se produjeron 48 desistimientos. De los autorizados, 629 eran comerciales y 171 no comerciales, es decir, sus promotores eran investigadores, grupos científicos, universidades y sociedades científicas.
Dentro del apartado de investigación, también se refieren a la actividad realizada con los estudios observacionales postautorización. En total, evaluaron 81.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: