El Comité Asesor para la Financiación de la Prestación Farmacéutica (CAFPF) ha elaborado un documento de consenso en el que explica su visión acerca de los Informes de Posicionamiento Terapéutico (IPT) y plantea cambios tanto en su configuración como en los procesos de elaboración.
El documento de consenso, emitido el pasado 9 de julio considera estos informes como “una herramienta importante para la selección de los medicamentos entre las alternativas existentes, para la prescripción y para fundamentar la toma de decisiones de precio y financiación”.
Como elementos clave de la elaboración de los IPT, el comité presidido por Félix Lobo, “considera necesaria e importante la incorporación sistemática de la evaluación económica de los medicamentos en los procesos de posicionamiento de los mismos en la terapéutica, decisión de financiación y precio y en las conclusiones de los IPT”. Además, señala que sería importante “profundizar” en cómo se incorpora esa información en el proceso de toma de decisiones sanitarias”.
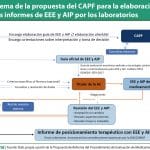
Para el CAFPF entre los aspectos de la elaboración de los IPT que es necesario abordar se encuentran cuestiones como el carácter vinculante de los mismos; el método de toma de decisiones; los recursos destinados a la elaboración de los IPT; la posibilidad de desarrollar documentos complementarios a los IPT; papel de la evaluación económica y el análisis de impacto presupuestario (AIP); incorporar las incertidumbres clínicas y económicas que rodean a las evaluaciones; así como la priorización de los medicamentos.
Plan estratégico de reforma de la prestación farmacéutica
En cuanto a la normativa, que incluye el “carácter vinculante de los IPT”, el CAFPF explica que, en caso de considerarse apropiado que existan excepciones a los criterios generales, “deben quedar reflejadas en el propio IPT”. Además, el Comité Asesor considera que es necesario elaborar un Plan estratégico de reforma de la regulación general de los medicamentos y de la Prestación Farmacéutica del SNS que se trasladaría a la Ley de Garantías y que se completaría con un desarrollo reglamentario.
Como es lógico, el CAFPF también pone el dedo en la llaga en uno de los aspectos cruciales de los IPT: la disponibilidad de recursos para desarrollarlos. Según el Comité “los recursos actuales del Ministerio de Sanidad para estos fines son insuficientes”, por lo que reclama una mayor dotación económica, pero “especialmente de personal bien formado”. El objetivo sería “disponer de una base de expertos en evaluación clínica y evaluación económica, además de contar con una red de evaluadores externos”.
El Comité considera necesario “fijar unos criterios objetivos de selección de expertos que atiendan a cuestiones científicas y no a criterios territoriales”. No obstante, señala que sería necesario establecer un “organismo científico-técnico independiente” en el que colaboraran la Dirección General de Cartera Común de Servicios del SNS y Farmacia, la Agencia Española de Medicamentos y las comunidades autónomas.
El papel de las CCAA y de la industria
El papel de las comunidades autónomas en todo este proceso y dentro del organismo independiente sería participar en la elaboración de la normativa legal, la planificación y evaluación “ex post” de los IPT en el seno del Consejo Interterritorial del SNS (CISNS) y la Comisión Permanente de Farmacia, participar en el Consejo Rector del organismo; facilitar los mejores profesionales técnicos; la revisión de los borradores y la puesta en práctica y difusión de los IPT entre los servicios sanitarios.
La participación de la industria en la elaboración de los IPT es uno de los apartados más destacados del documento junto a la inclusión de la evaluación económica. El Comité de Lobo considera que los estudios de evaluación económica e impacto presupuestario que elabora la industria en base de los resultados y conclusiones de la evaluación comparativa desarrollada por la administración deben poder aportarse al IPT. Además, el CAFPF considera que la industria “debe tener el derecho a realizar las aportaciones necesarias (…) sobre evaluación farmacológica/clínica comparativa, evaluación económica e impacto presupuestario”.
A este respecto, el Comité considera “razonable” que se pueda solicitar a la industria que presente una “evaluación económica y el AIP de acuerdo a sus estimaciones y modelos económicos siguiendo una guía metodológica definida por el Ministerio”. Eso sí, “los cálculos y modelos presentados por la industria deberán ser evaluados para su aceptación, y en todo caso, podrán ser sometidos a un proceso de revisión y ajuste de acuerdo con las consideraciones clínicas y económicas de la primera fase de la evaluación”.
Evaluación económica
Para el CAFPF, es “necesario concretar el papel de la evaluación económica en los procesos de decisión de precios y financiación y en la elaboración de los IPT”. A este respecto, considera que “los criterios y directrices básicas de los estudios de evaluación económica deben especificarse en una estrategia general sobre medicamentos del Ministerio de Sanidad y en un plan de mejora de los IPT”.
En este sentido, según dicen, “una de las cuestiones más complejas es definir criterios de decisión como la consideración de valores de referencia para contextualizar el coste por unidad de resultado, siguiendo los criterios de buena práctica en evaluación económica”.
Tal y como reconocen, “la valoración de información de calidad procedente de la evaluación de eficacia y seguridad relativas, de coste-efectividad y coste-utilidad siempre que ello sea posible, tal como es metodología estándar en muchos países y está bien fundamentado en la teoría económica, así como de impacto presupuestario, es necesaria para sustentar la decisión de precio y financiación”. En este sentido, consideran que “las decisiones de financiación y precio basadas en el valor maximizan el bienestar social y no deben ser interpretadas como equivalentes a precios iguales a la máxima disposición a pagar”, por lo que “el precio del fármaco debería estar ajustado por un intervalo máximo igual al umbral de coste-utilidad y un intervalo bajo igual a los costes de fabricación e investigación del medicamento”. El CAFPF reconoce “la dificultad de conocer el límite bajo del precio”, sin embargo, consideran que es “importante” que la industria proporcione estos costes de producción y de investigación reales de los medicamentos.
El CAFPF también ha querido establecer el momento en el que es posible realizar la evaluación económica y la fijación de precios ya que los estudios de coste-efectividad y coste-utilidad “necesariamente deben ser posteriores a la evaluación comparativa farmacológica/clínica”. A este respecto, destacan que el beneficio clínico incremental “es un concepto clave para la evaluación del valor y, por consiguiente, para las decisiones sobre precios y financiación pública”.
El comité considera que “la evaluación económica debe ser un elemento más de evaluación en el IPT”. No obstante, incorporar la evaluación económica después de la decisión de precio y financiación, “no ayuda a tomar una decisión más informada”, por lo que según indican, estos estudios “deben preceder a las decisiones de precio y financiación para que éstas se basen en sus conclusiones”. Para hacerlo posible, el precio del medicamento se debe incorporar como una variable con incertidumbre y realizar estudios de sensibilidad en función del mismo. De este modo, el CAFPF considera necesario que incluir la evaluación económica en los IPT debe constar de dos fases: una previa a la fijación de precios, con lo que se utilizaría en la fase de negociación, y otro tras la fijación de precio, lo que posicionaría finalmente el producto.
Independientemente de la evaluación económica, el CAFPF considera “preciso seguir avanzando en la valoración comparativa del beneficio clínico incremental frente a las alternativas”. En las especificaciones de esta evaluación del beneficio clínico comparativo es en las “debe pivotar la evaluación económica”, señala el documento de consenso.
Procedimientos, guías y buen gobierno
En cuanto a los procedimientos, el CAFPF considera necesario desarrollar diversas guías específicas de cada procedimiento para tratar aspectos concretos que reflejen el desarrollo científico-técnico en estas materias contando con un amplio consenso multidisciplinar. Entre ellas propone una guía de evaluación económica, guía de impacto presupuestario, guía de comparaciones indirectas, guía de análisis de subgrupos, guía de análisis de supervivencia, etc.”
Por último, el Comité Asesor también aborda la necesidad de un ‘buen gobierno’ para todo el proceso. Así, considera que “los procesos de evaluación farmacológica y clínica comparativa, los de evaluación económica y AIP, así como los propios IPT, deben estar sujetos a los principios de buen gobierno” que, aunque están recogidos en la legislación “no hemos alcanzado plenamente en estas materias”. Entre dichos principios citan “la eliminación de los conflictos de intereses, la profesionalidad de los órganos de la Administración y la independencia respecto del poder político de los expertos que elaboran las evaluaciones”.
Igualmente, ponen en valor la transparencia, incluidas las informaciones explicativas dirigidas a los ciudadanos y la rendición de cuentas, que “son imprescindibles siempre, pero más en un campo en el que están en juego decisiones que afectan a la salud de los ciudadanos”.
Por último, el documento finaliza señalando que el establecimiento de un procedimiento completo de elaboración de los IPT “requiere la adopción de guías de evaluación y procedimientos transparentes con normas claras y posibilidad de audiencia y recurso para los distintos agentes intervinientes”.






















 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: