El Instituto Nacional de Gestión Sanitaria (Ingesa) está planteándose paralizar el acuerdo marco de compra de medicamentos con biosimilar autorizado que inició su tramitación el pasado mes de febrero.
Desde el Ingesa se ha confirmado a preguntas de Diariofarma esta posibilidad y se ha explicado que, actualmente están preguntando a las comunidades autónomas adheridas al acuerdo marco de biosimilares “si consideran oportuno continuar con él, tal y como se redactó hace unos meses o si, por el contrario, creen necesario la renuncia del expediente en curso para iniciar un nuevo que incorpore nuevos medicamentos autorizados”.
A este respecto, cabe señalar que, desde febrero pasado, cuando el Gobierno autorizó al Ingesa la celebración de este acuerdo marco no se ha autorizado ningún nuevo medicamento biosimilar en España. No obstante, según la base de datos del Centro de Información de Medicamentos de la Aemps (CIMA), sí que se ha producido la llegada a nuestro país de nuevas formulaciones de medicamentos que podrían pertenecer a otros lotes. Se trata de las versiones en pluma precargada de Infliximab, comercializado por Kern Pharma y la de Teriparatida, comercializada por Theramex. Estos podrían ser los medicamentos para los que se estaría pensando reiniciar el acuerdo marco ya que se trata de las primeras versiones biosimilares de los tratamientos subcutáneos de sus respectivos principios activos.
Unos pliegos con polémica
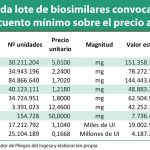
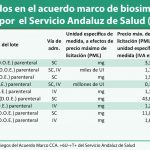
Los pliegos de este acuerdo marco fueron objeto de polémica hace unos meses cuando se conocieron los borradores del mismo. Según pudo comprobar Diariofarma, en este concurso se establecía la obligación por parte de las comunidades autónomas de adquirir el medicamento más barato. No obstante, el precio más barato podía cambiar a lo largo de la duración del contrato y obligaría a contratar al nuevo medicamento más económico, lo que supondría en la práctica una suerte de subasta continua.
Además, se limitarían mucho las excepciones a la prescripción médica para permitir mantener en un paciente el medicamento que estaba recibiendo. Según se desprende del borrador de los pliegos, se estaría eliminando la posibilidad de adquisición en función de las necesidades de pacientes y clínicos.
Todo ello, daría lugar a cambios continuos de los tratamientos que se ofrecieran a los pacientes en función del precio más barato del momento. A este respecto, la tristemente desaparecida directora general de Biosim, Regina Múzquiz, ya señaló a Diariofarma en una entrevista que aunque consideran válida la realización de un switch desde el fármaco original a un biosimilar, no son “partidarios de que haya multiswitch exclusivamente por precio y que estemos continuamente cambiándole el fármaco al paciente”.
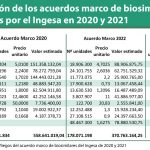
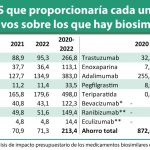
Cabe recordar que el Acuerdo Marco se estaría desarrollando en nueve lotes (adalimumab; etanercept; infliximab; rituximab; trastuzumab; somatropina; pegfilgastrim; epoetina alfa y filgastrim) y que tendría una duración de dos años ampliable por otro más y está valorado en más de 371 millones de euros, más 188 millones de la prórroga.


















 Nicolas Gonzalez Casares:
Nicolas Gonzalez Casares: