Cal y arena en la financiación de medicamentos oncológicos con fondos públicos. Mientras que el 90% de los medicamentos evaluados indicados en esta área resultaron financiados por el Sistema Nacional de Salud, el plazo para alcanzar dicha resolución desde la aprobación por parte de la Comisión Europea fue de 416 días.
Así se extrae de los datos contenidos en el segundo informe de evolución de la financiación y fijación de precio de los medicamentos en el SNS (2016-2021) publicado por la Dirección General de Cartera Común de Servicios del SNS y Farmacia (DGCCF), que en esta ocasión se ha centrado en los medicamentos oncológicos.
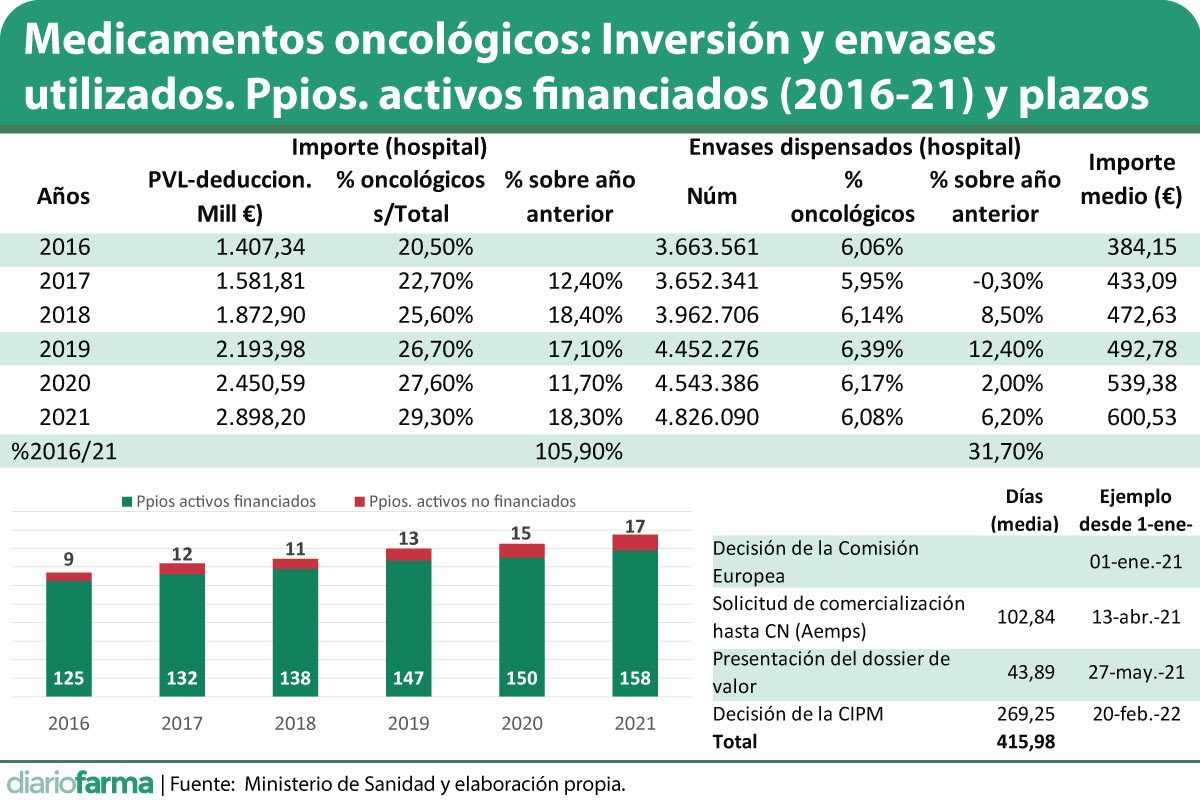
El Ministerio de Sanidad explica en dicho informe que en 2021 había un total de 158 principios activos con indicaciones en el campo de la oncología con resolución favorable de financiación, lo que supone el 90% sobre el total de medicamentos con estas indicaciones incluidos en el nomenclátor. Cabe destacar que de acuerdo con estos datos solo se habría rechazado la financiación de 16 medicamentos registrados en la Agencia Española de Medicamentos (Aemps), mientras que estarían actualmente en estudio de financiación 22 principios activos. El total de principios activos oncológicos registrados por la Aemps serían 197, disponiendo de resolución de financiación 175, de los que en 17 ocasiones habría sido desfavorable.
Se da la circunstancia de que en España hay registrados 46 principios activos adicionales a los 151 que cuentan con la autorización de la CE debido a las autorizaciones alcanzadas por procedimientos nacionales, descentralizados o de reconocimiento mutuo. Por el contrario, solo hay cinco principios activos autorizados por la CE que no están registrados en España debido a que el titular aún no lo ha solicitado.
Pese a estas relevantes cifras de autorizaciones de principios activos, en el informe no se recogen datos acerca de las indicaciones solicitadas y cuáles han sido o no finalmente financiadas por fondos públicos, aspecto muy relevante especialmente en el caso de los medicamentos indicados para oncología que van ganando sucesivas indicaciones según se avanza en los diferentes proyectos de investigación clínica en marcha.
Plazos hasta autorización
En lo que sin duda es necesario mejorar es en los plazos que transcurren desde que el medicamento es autorizado por la Comisión Europea (CE) hasta que se logra una resolución de financiación por parte de la DGCCF. Una media de 416 días, casi un año y dos meses, tienen que esperar los pacientes a que haya resolución, a lo que habría que sumar los distintos procesos autonómicos y hospitalarios posteriores. Un medicamento que hubiera sido aprobado por la CE el 1 de enero de 2021, no habría llegado a tener precio y reembolso en España hasta el 20 de febrero de 2022. Esta es, la cuestión más relevante a la que hay que dar respuesta en los próximos años de cara al acceso a la innovación.
Sanidad, no obstante, detalla los distintos plazos para atribuir responsabilidades a la industria en esta cuestión. Según explica, el tiempo medio desde la autorización de la CE hasta que el laboratorio solicita la comercialización en nuestro país, y se le asigna un código nacional registrándose así en la Aemps, es de 102,84 días. Posteriormente, transcurrirían otros 43,89 días hasta que el laboratorio titular presenta el dossier con la primera oferta de precio y, finalmente, se destinan otros 269,25 días para que la Comisión Interministerial de Precios de los Medicamentos (CIPM) adopta su decisión desde que el laboratorio presenta el dossier de valor con la primera propuesta de precio, teniendo en cuenta que se presentan entre 3 y 8 por cada expediente y se analiza en dos o tres reuniones de la CIPM, señala el informe.
De este modo, Sanidad atribuiría la responsabilidad de al menos un 35% del tiempo transcurrido a los laboratorios, mientras que el proceso administrativo de fijación de precio y decisión de reembolso sería competencia del ámbito público.
Impacto económico
El informe también dedica un amplio capítulo a analizar el impacto económico de los medicamentos oncológicos en el SNS. De acuerdo con sus datos, oncología supone el 29,35% del gasto farmacéutico hospitalario y el 2,49% del gasto a través de recetas. El total ascendería a 3.109,92 millones de euros, un 16,91% del total de inversión en medicamentos.
Además, Sanidad resalta que el consumo de estos medicamentos se incrementa año a año tanto en facturación como en envases. En 2021, comparándolo con 2020, se produce un incremento tanto en número de envases como en importe de un 5,1% y de un 16,9% respectivamente, asegura el estudio. Si se compara el consumo en importe de 2021 en relación a 2016, el crecimiento asciende a un 105,9%, mientras que en lo que se refiere al número de envases ha crecido un 31,7%.
Sanidad también destaca que el precio medio a PVL de las presentaciones de medicamentos oncológicos incluidos en la prestación farmacéutica autorizados es de 1.222,90 euros, lo que supone unas 15 veces por encima del precio medio de los medicamentos financiados (177,86 euros). No obstante, Diariofarma ha calculado el precio medio de los medicamentos utilizados y, en este caso, el importe medio baja hasta los 600,52 euros si se consideran solo los medicamentos hospitalarios o 379,85 si también se incluye en el cálculo los medicamentos dispensados a través de receta médica.
El informe también aborda la “alta incertidumbre clínica” asociada a la utilización de estos medicamentos. Una incertidumbre motivada por la limitación de datos existentes a la hora de aprobar estos medicamentos ya que “un porcentaje importante son aprobados de manera condicional, con resultados basados en fases tempranas de investigación (fase II), con estudios de un único brazo, con pequeño tamaño muestral y en muchos casos basados en variables subrogadas en vez de variables clínicas relevantes”, lo que se traduciría en “incertidumbre financiera, que tensiona y pone en riesgo la sostenibilidad de los sistemas sanitarios”, indica.
Además, se considera que el impacto económico de estos nuevos medicamentos oncológicos de precisión “es elevado, por lo que uno de los mayores retos de la política farmacéutica a nivel nacional y mundial es la incorporación sostenible de los nuevos medicamentos”.








 Lilisbeth Perestelo:
Lilisbeth Perestelo:  César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):