El ‘Plan de Acción para fomentar la utilización de los medicamentos genéricos y biosimilares en el SNS’, que ya está consensuado con las comunidades autónomas, a través de la Comisión Permanente de Farmacia, verá la luz dentro de algún tiempo, cuando la situación epidemiológica de la covid-19 permita al Consejo Interterritorial del SNS (CISNS) “tratarlo con el tiempo y la reflexión adecuada que el plan merece”, según la directora general de Cartera Común de Servicios del SNS y Farmacia, Patricia Lacruz.
Lacruz realizó esta consideración en el marco de la III Jornada Nacional de Biosimilares organizada por la Asociación Española de Biosimilares (Biosim) este viernes, a lo largo de una ponencia en la que presentó las características generales del Plan, así como las modificaciones más relevantes desde que se sometiera a audiencia pública en octubre de 2019.
Según explicó la directora general, la esencia del plan no ha cambiado y prácticamente la modificación más relevante se refiere al título ya que previamente era Plan de acción para fomentar la utilización de los medicamentos reguladores del mercado en el SNS: medicamentos genéricos y biosimilares. A este respecto, Lacruz señaló que se ha atendido a la solicitud de numerosas peticiones del proceso de audiencia.
La directora general quiso dejar claro que el plan es fruto de “un reto común y un objetivo compartido por todos los integrantes de la Comisión Permanente de Farmacia” que consisten en “fomentar la utilización de los genéricos y biosimilares, reduciendo sus barreras de entrada en el SNS” ya que, según aseguró “los biosimilares constituyen una gran oportunidad para los sistemas sanitarios por fomentar no solo la sostenibilidad sino también la innovación terapéutica al introducir competencia en el mercado de medicamentos biológicos sin patente”.
Posicionamiento sobre intercambiabilidad
Lacruz también avanzó que la Agencia Española de Medicamentos (Aemps) está trabajando en un posicionamiento en materia de intercambiabilidad de medicamentos biológicos. A este respecto, señaló su intención de “alcanzar un acuerdo conjunto en la Comisión Permanente de Farmacia”. Eso sí, la directora general se mostró convencida de que el camino es “el convencimiento, la generación de confianza, la muestra de resultados y la evidencia científica puesta encima de la mesa” y “no la obligación”.
Para la representante del Ministerio de Sanidad, el impulso a los biosimilares es una “apuesta de presente y futuro a nivel global”, ya que introducen competencia en el mercado y “reducen el coste de los tratamientos con garantías”. Por ello, puso de manifiesto la apuesta que se hace por ellos no solo desde el Ministerio de Sanidad, sino también desde la Comisión Europea y, al respecto, citó la reciente estrategia farmacéutica europea. Entre sus contenidos Lacruz citó las llamadas a revisar la legislación farmacéutica para abordar la competencia en el mercado, la intercambiabilidad y las implicaciones de la cláusula Bolar.
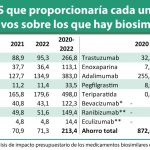
Durante su presentación, la directora general expuso una serie de datos sobre la penetración de los medicamentos biosimilares en el mercado español. “En media, la penetración en España es la décima de Europa”, aseguro, mientras ponía de manifiesto la existencia de diferencias tanto entre comunidades autónomas como entre principios activos. En este sentido, aseguró que cuando observa “datos con gran desviación estándar creo que hay oportunidades de mejora”. A este respecto, consideró “sorprendente” el bajo uso de determinados medicamentos biosimilares que llevan ya un tiempo en el mercado. No nombró ninguno pero de las gráficas presentadas se entiende que se refería a folitropina alfa, somatotropina o a insulina glargina. “Tenemos que impulsar medidas para el crecimiento de los biosimilares para que se produzca de forma ágil”, planteó ante esta situación. Unas medidas que, en el marco del debate Lacruz situó dentro del plan ya que se ha desarrollado “con ese objetivo”, para que las buenas prácticas “se homogeneicen y se desarrollen en el SNS”. Para lograrlo, durante el debate se puso de manifiesto la necesidad de contar con información y datos y, a este respecto, Lacruz puso encima de la mesa Valtermed, el sistema de información sobre valor terapéutico de medicamentos que, aunque actualmente solo se utiliza en medicamentos con alta incertidumbre sanitaria o económica, la interoperabilidad con los sistemas de información de las comunidades autónomas permitirá “obtener datos compartidos” de otras materias.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: